
【题目】将浓盐酸滴入KMnO4溶液,产生黄绿色气体,溶液的紫红色褪去,向反应后的溶液中加入NaBiO3,溶液又变为紫红色,BiO3-反应后变为无色的Bi3+。据此判断下列说法正确的是( )
A.滴加盐酸时,HCl是还原剂,Cl2是还原产物
B.已知Bi为第ⅤA族元素,上述实验说明Bi具有较强的非金属性
C.若有0.1 mol NaBiO3参加了反应,则整个过程转移电子0.4NA
D.此实验条件下,物质的氧化性:KMnO4 > NaBiO3 > Cl2
【答案】C
【解析】
试题分析:A.滴加盐酸时,生成氯气,Cl元素的化合价升高,则HCl是还原剂,Cl2是氧化产物,故A错误;B.上述反应中Bi得到电子,+3价较稳定,不能说明Bi单质的氧化性,则不能说明Bi具有较强的非金属性,故B错误;C.若有0.1 mol NaBiO3参加了反应,则整个过程转移电子为0.1mol×(5-3)+0.1mol×![]() ×(7-2)=0.4mol,即0.4NA,故C正确;D.氧化剂的氧化性大于氧化产物的氧化性,则2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O中氧化性为高锰酸钾的氧化性大于氯气,2Mn2++5NaBiO3+14H+=2MnO4-+5Na++5Bi3++7H2O中NaBiO3的氧化性大于高锰酸钾,所以氧化性强弱顺序是:NaBiO3>KMnO4>Cl2,故D错误;故选C。
×(7-2)=0.4mol,即0.4NA,故C正确;D.氧化剂的氧化性大于氧化产物的氧化性,则2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O中氧化性为高锰酸钾的氧化性大于氯气,2Mn2++5NaBiO3+14H+=2MnO4-+5Na++5Bi3++7H2O中NaBiO3的氧化性大于高锰酸钾,所以氧化性强弱顺序是:NaBiO3>KMnO4>Cl2,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36 号元素),对 比中学常见元素周期表思考扇形元素周期表的 填充规律,并用化学用语.回答下列问题:
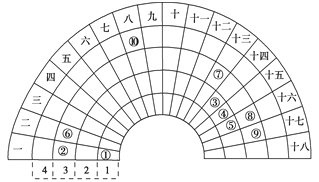
(1)若①~⑩分别代表十种元素,则⑧代表的元素在常见周期表中的位置是____________
(2)比较元素最高价氧化物对应水化物的碱性:②_____________⑥(填“>”或“<”)
(3)写出一种由①、④、⑤三种元素形成的常见离子化合物:___________,设计一个简单的实验检验其阳离子的存在:___________________。
(4)用电子式表示⑥、⑨形成化合物的过程:_______________。
(5)①、③、⑤三种元素形成的18 电子结构的化合物是近年来燃料电池研究领域的新宠,写出用它作燃料,②的最高价氧化物对应的水化物作电解质的燃料电池的负极反应式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在稀溶液中,强酸跟强碱发生中和反应生成1 mol水时的反应热叫做中和热。现利用如图装置进行中和热的测定,请回答下列问题:
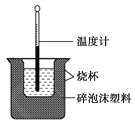
(1)该图中有两处未画出,它们是______________、________________。
(2)做一次完整的中和热测定实验,温度计需使用________次。
(3)把温度为15.0 ℃,浓度为0.5 mol·L-1的酸溶液和0.55 mol·L-1的碱溶液各50 mL混合(溶液密度均为1 g·mL-1),生成溶液的比热容c=4.18 J · g-1 · ℃-1,轻轻搅动,测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1/℃ | 终止温度t2/℃ | 中和热 |
HCl+NaOH | 15.0 | 18.4 | ΔH1 |
HCl+NH3·H2O | 15.0 | 18.1 | ΔH2 |
①计算上述第一组实验测出的中和热ΔH1=______。
②写出HCl+NH3·H2O的热化学方程式:____________________________________。
③两组实验结果差异的原因是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铁铜的混合物中,加入一定量的稀硝酸并微热,充分反应后,剩余金属a g,再向其中加入一定量的稀盐酸并加热,充分振荡后,还剩余金属b g ,则 ( )
A. a可能等于b B. a一定等于b C. a可能小于b D. a一定大于b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )
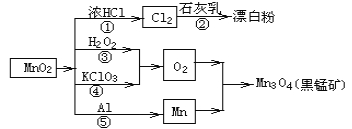
A.反应①②③④⑤均属于氧化还原反应和离子反应
B.反应⑤说明该条件下铝的还原性强于锰
C.相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶1
D.反应①中氧化剂与还原剂的物质的量之比为1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾分别在酸性、中性、碱性条件下发生的反应如下:
MnO![]() +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O
MnO![]() +3e-+2H2O===MnO2↓+4OH-
+3e-+2H2O===MnO2↓+4OH-
MnO![]() +e-===MnO
+e-===MnO![]() (溶液呈绿色)
(溶液呈绿色)
(1)从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的_______影响。
(2)将SO2通入高锰酸钾溶液中,发生氧化还原反应的离子方程式为______________。
(3)将PbO2投入酸性MnSO4溶液中搅拌,溶液变为紫红色。下列说法正确的是________(填字母)。
a.氧化性:PbO2>KMnO4
b.还原性:PbO2>KMnO4
c.MnSO4溶液可以用盐酸酸化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质说法正确的是( )
A. 能导电的物质叫电解质
B. ![]() 晶体不导电,所以
晶体不导电,所以![]() 不是电解质
不是电解质
C. 电解质在通电时发生电离
D. 熔融的![]() 导电,所以
导电,所以![]() 是电解质
是电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com