
| A. | CO2分子的结构式O-C-O | B. | 乙醇的分子式C2H6O | ||
| C. | Mg2+结构示意图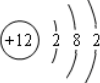 | D. | NaCl的电子式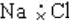 |
分析 A.二氧化碳分子中含有两个碳氧双键;
B.乙醇为含有2个碳原子的饱和一元醇;
C.镁离子的核外电子总数为10,最外层含有8个电子;
D.氯化钠为离子化合物,阴离子需要标出最外层电子.
解答 解:A.CO2分子中含有两个碳氧双键,其正确的结构式为:O=C=O,故A错误;
B.乙醇分子可以看作1个羟基取代了乙烷分子中的1个H形成的,其分子式为C2H6O,故B正确;
C.镁离子的核电荷数为12,最外层达到8电子稳定结构,其正确的结构示意图为: ,故C错误;
,故C错误;
D.NaCl为离子化合物,由钠离子与氯离子构成,正确的电子式为 ,故D错误;
,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、离子结构示意图、结构式、分子式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:实验题
 .
. .
.| 碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
查看答案和解析>>
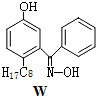
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
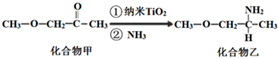
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质组别 | 甲 | 乙 | 丙 |
| A | NH3 | O2 | HNO3 |
| B | Al | HCl | NaOH |
| C | SiO2 | NaOH | HCl |
| D | CO2 | Ca(OH)2 | NaHSO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合浓硫酸和乙醇时,应将乙醇慢慢注入到浓硫酸中 | |
| B. | 萃取、配制物质的量浓度的溶液都要用到玻璃棒 | |
| C. | 用丁达尔效应可鉴别溶液和胶体 | |
| D. | 可用氢氧化钠溶液除去乙酸乙酯中混有的乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径比钾的原子半径大 | B. | 氯化物难溶于水 | ||
| C. | 其氢氧化物的碱性比NaOH强 | D. | 碳酸盐难溶于水 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学卷(解析版) 题型:选择题
①酒精 ②苯 ③四氯化碳 ④分液 ⑤萃取 ⑥蒸馏
A. ②④ B. ②④⑤ C. ②④⑤⑥ D. ③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com