
下列指定反应的离子方程式正确的是
A.用稀硫酸去除铜器表面的Cu2(OH)2CO3:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O
B.用稀硝酸去除试管内壁的银镜:Ag+NO3-+2H+=Ag++NO2↑+H2O
C.向AlCl3溶液中加入氨水制Al(OH)3:Al3++3OH-=Al(OH)3↓
D.向FeI2溶液中加入盐酸和过量的H2O2:2I-+H2O2+2H+=I2+2H2O
科目:高中化学 来源:2014-2015学年四川省广安市高三“一诊”理综化学试卷(解析版) 题型:填空题
(13分) A、B、C、D、E、F、G、H是核电荷数依次增大的短周期主族元素。元素A的原子半径是所有元素中最小的。A、E同主族,B、C、D同周期,D、G最外层电子数相等,G的质量数为D的2倍,元素B的一种常见单质可做惰性电极材料,其最高价氧化物甲为常见温室气体。B、D、G的质子数之和等于F、H的质子数之和,I单质是日常生活中用量最大的金属,易被腐蚀或损坏。回答下列问题:
(1)I元素在周期表中的位置 。
(2)化合物甲的结构式为 。
(3)根据以上信息,下列说法不正确的是______________。
A.A和B能形成多种化合物
B.热稳定性: H2D< H2G
C.元素G的最高价氧化物对应水化物的酸性比H的弱
D.简单离子半径的大小顺序:rD <rE<rF E.沸点:H2D< H2G
F.同温同压下,将a L CA3和b L AH通入水中,若所得溶液的pH=7,则a>b
(4)常温下,相同浓度F、I简单离子的溶液中滴加NaOH溶液,F、I两元素先后沉淀,F (OH)n完全沉淀的pH是4.7,I (OH)n完全沉淀的pH是2.8,则ksp较大的是: (填化学式)
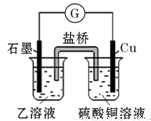
(5)若在H与I组成的某种化合物的溶液乙中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图所示,其反应中正极电极反应式为 。
(6)若用石墨电极电解含有0.04 mol CuGD4和0.04 mol EH的混合溶液400 mL,当阳极产生的气体784 mL(标况)时,溶液的pH= (假设电解后溶液体积不变)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三质量检测化学试卷(解析版) 题型:选择题
25℃时,下列各溶液中有关微粒物质的量浓度关系正确的是
A.0.1 mol·L-1Na2S溶液中:2c(Na+) =c(S2-)+c(HS-) +c(H2S)
B.pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合:c(Na+)+ c(H+)= c(OH-)+c(CH3COO-)
C.0.1 mol·L-1盐酸与0.1 mol·L-1K2CO3溶液等体积混合:c(K+) >c(Cl-)>c(HCO3-)>c(OH-)>c(H+)
D.0.1 mol·L-1NH4HSO4溶液中滴加NaOH至溶液恰好呈中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-) =c(H+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三一模化学试卷(解析版) 题型:实验题
(15分)利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3?18H2O]。
I.实验室制取无色的无水AlBr3(熔点:97.5℃,沸点:263.3~265℃)可用如图所示装置,
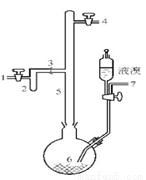
主要实验步骤如下:
步骤l.将铝箔剪碎,用CCl4浸泡片刻,干燥,然后投入到烧瓶6中。
步骤2.从导管口7导入氮气,同时打开导管口l和4放空,一段时间后关闭导管口7和1;导管口4接装有五氧化二磷的干燥管。
步骤3.从滴液漏斗滴入一定量的液溴于烧瓶6中,并保证烧瓶6中铝过剩。
步骤4.加热烧瓶6,回流一定时间。
步骤5.将氮气的流动方向改为从导管口4到导管口l。将装有五氧化二磷的干燥管与导管口1连接,将烧瓶6加热至270℃左右,使溴化铝蒸馏进入收集器2。
步骤6.蒸馏完毕时,在继续通入氮气的情况下,将收集器2从3处拆下,并立即封闭3处。
(1)步骤l中,铝箔用CCl4浸泡的目的是 。
(2)步骤2操作中,通氮气的目的是 。
(3)步骤3中,该实验要保证烧瓶中铝箔过剩,其目的是 。
(4)铝与液溴反应的化学方程式为 。
(5)步骤4依据何种现象判断可以停止回流操作 。
(6)步骤5需打开导管口l和4,并从4通入N2的目的是 。
II.某课外小组的同学拟用废铝箔制取硫酸铝晶体,已知铝的物种类别与溶液pH关系如图所示,实验中可选用的试剂:处理过的铝箔;2.0mol?L-1NaOH溶液:2.0 mol?L-1硫酸

(7)由铝箔制备硫酸铝晶体的实验步骤依次为:
①称取一定质量的铝箔于烧杯中,分次加入2.0 mol?L-1NaOH溶液,加热至不再产生气泡为止。
②过滤 ③ ;
④过滤、洗涤 ⑤ ;⑥ ;
⑦冷却结晶; ⑧过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三一模化学试卷(解析版) 题型:选择题
从植物中分离出的活性化合物zeylastral的结构简式如图所示。
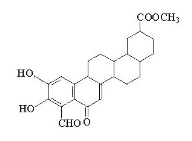
下列说法不正确的是
A.分子中含有6个手性碳原子
B.能与FeCl3溶液、银氨溶液发生反应
C.1mol zeylastral最多与5molH2发生反应
D.1mol zeylastral最多可与lmolBr2发生反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三一模化学试卷(解析版) 题型:选择题
三氟化硼二甲醚配合物是一种有机催化剂。下列相关构成微粒的表示不正确的是
A.二甲醚的结构简式:C2H6O
B.中子数为5的硼原子: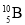
C.氟原子结构示意图: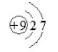
D.三氟化硼的电子式:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省连云港等四市高三一模化学试卷(解析版) 题型:推断题
(15分)黄酮类化合物具有抗肿瘤活性,6-羟基黄酮衍生物的合成路线如下:

请回答下列问题:
(1)化合物B中的含氧官能团为 和 (填名称)。
(2)反应③中涉及到的反应类型有水解反应、 和 。
(3)反应④中加入的试剂X的分子式为C7H5OCl,X的结构简式为 。
(4)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有4种不同化学环境的氢。
写出该同分异构体的结构简式: 。
(5)已知: 。
。
根据已有知识并结合相关信息,写出以 和CH3COOH为原料制备
和CH3COOH为原料制备 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
H2C CH2
CH2 CH3CH2Br
CH3CH2Br CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏常州市高三第一次调研试卷化学试卷(解析版) 题型:填空题
(12分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素。A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子。
(1)基态的F3+核外电子排布式是 。
(2)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物,原因是 。
(3)化合物FD3是棕色固体、易潮解、100℃左右时升华,它的晶体类型是 ;化合物ECAB中的中的阴离子与AC2互为等电子体,该阴离子的电子式是 。

(4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是 。
(5)化合物EF[F(AB)6]是一种蓝色晶体,下图表示其晶胞的 (E+未画出)。该蓝色晶体的一个晶胞中E+的个数为 。
(E+未画出)。该蓝色晶体的一个晶胞中E+的个数为 。
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示

其晶胞边长为540.0 pm,密度为 (列式并计算),a位置S2-离子与b位置Zn2+离子之间的距
离 pm(列式表示)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省深圳市高三第一次调研考试理综化学试卷(解析版) 题型:选择题
下列离子方程式错误的是
A.石灰石和盐酸反应制CO2:CaCO3 + 2H+ = CO2↑+ Ca2+ +H2O
B.稀Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-= 3Fe3++NO↑+2H2O
C.Ca(ClO)2 溶液中通入过量的SO2:C1O-+ SO2 + H2O = HClO + HSO3-
D.铜溶于FeCl3溶液中:Cu + 2Fe3+ =2 Fe2+ + Cu2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com