
已知A、B、C、D、E、F、G位于元素周期表的前四周期,且元素原子序数依次增加,A焰色反应呈黄色;工业常用电解B的熔融的氯化物来制备B,C是一种能被HF和NaOH溶液溶解的单质,D的电负性比磷大,第一电离能却比磷小,E单质是制备漂白液的原料,F能形成红色(或砖红色)和黑色的两种氧化物,G是一种主族金属。
(1)前四周期所有元素中,基态原子中未成对电子与其所在周期数相同的元素有 种。
(2)元素A、B、C分别与氟气化合形成物质X、Y、Z熔点见下表:
氟化物 | X | Y | Z |
熔点/K | 1266 | 1534 | 183 |
解释表中氟化物熔点差异的原因: 。
(3)已知常温条件下,极性分子DOE2是一种液态化合物,中心原子D的杂化方式是 。向盛有10mL水的锥形瓶中滴加少量的DOE2溶液,生成两种有刺激性气味的气体。请书写此反应的化学方程式 。
(4)G与氮原子可1:1化合,形成人工合成的新型半导体材料,其晶体结构与单晶硅相似。G原子的价电子排布式为 。在该合成材料中,与同一个G原子相连的N原子构成的空间构型为正四面体。在四种基本晶体类型中,此晶体属于 晶体。
(5)F晶体的堆积方式是 (填堆积名称),其配位数为 。 向F的硫酸盐溶液中滴加氨水直至过量,写出此过程所涉及的两个离子方程式 根据价层电子对互斥理论,预测SO42-的空间构型为 。
(1)5(1分)
(2)NaF和MgF2为离子晶体,SiF4为分子晶体,(1分) MgF2的晶格能大于NaF(1分) (3)SP3(1分) SOCl2 + H2O = SO2↑+ 2HCl↑(2分)
(4)4s2p1(1分),原子(1分)
(5)面心立方最密堆积(1分), 12(1分), Cu2+ + 2NH3·H2O = Cu(OH)2↓+ 2NH4+(2分)Cu(OH)2 + 4NH3·H2O = [Cu(NH3)4]2+ + 4H2O + 2OH-(或将NH3·H2O写成NH3)(2分), 正四面体(1分)
【解析】
试题分析:A、B、C、D、E、F、G位于元素周期表的前四周期,且元素原子序数依次增加,A焰色反应呈黄色是Na;工业常用电解B的熔融的氯化物来制备B,是Mg;C是一种能被HF和NaOH溶液溶解的单质,是Si;D的电负性比磷大,第一电离能却比磷小,是S;E单质是制备漂白液的原料,为Cl;F能形成红色(或砖红色)和黑色的两种氧化物,为Cu;G是一种主族金属。
(1)前四周期所有元素中,基态原子中未成对电子与其所在周期数相同的元素有1s1,2s22p2或2s22p4,3s23p3,3d64s2(注意根据洪特规则3d44s2是3d54s1),共5种。
(2)元素Na、Mg、Si分别与氟气化合形成物质X(NaF)、Y(MgF2)、Z(SiF4)熔点NaF和MgF2为离子晶体,SiF4为分子晶体,MgF2的晶格能大于NaF。
(3)已知常温条件下,极性分子SOCl2是一种液态化合物,中心原子S有价层电子4对,杂化方式是SP3。向盛有10mL水的锥形瓶中滴加少量的SOCl2溶液,生成两种有刺激性气味的气体为水解,即SO2和HCl。
(4)G与氮原子可1:1化合,形成人工合成的新型半导体材料,其晶体结构与单晶硅相似。物质分子式是GN,G为+3价,在Cu之后,故是G原子的价电子排布式为4s2p1。在该合成材料中,与同一个G原子相连的N原子构成的空间构型为正四面体。在四种基本晶体类型中,此晶体属于原子晶体。
(5)Cu晶体的堆积方式是面心立方最密堆积,其配位数为12。 向CuSO4溶液中滴加氨水直至过量,Cu2+先生成Cu(OH)2沉淀,在溶解为[Cu(NH3)4]2+,根据价层电子对互斥理论,SO42-的价层电子为4对,空间构型为正四面体。
考点:物质结构与性质。


科目:高中化学 来源:2013-2014湖南省衡南县高一下学期期末考试化学试卷(解析版) 题型:选择题
下列各项中表达正确的是( )
A.F原子结构示意图: 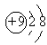 B.H2O的电子式:
B.H2O的电子式:
C.1H、2H、3H是三种不同元素 D.乙烯的分子式: C2H4
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省益阳市高一上学期期末考试化学(理)试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数的数值。下列有关叙述正确的是( )
A.标准状况下,22.4L水中含有的分子数为NA
B.11.2LNH3中所含的质子数为5NA
C.常温常压下,48gO3含有的氧原子数为3NA
D.2.4g 金属镁变为镁离子时失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省怀化市高三第三次模拟考试理综化学试卷(解析版) 题型:填空题
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中。“硫酸法”生产钛的原料是钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质);主要生产流程如下:
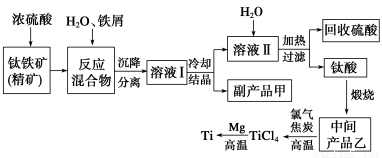
已知反应:①将钛铁矿与浓H2SO4煮【解析】
FeTiO3+2H2SO4(浓)△TiOSO4(硫酸氧钛)+FeSO4+2H2O。②加水热分解硫酸氧钛:TiOSO4+(n+1)H2O△TiO2·nH2O+H2SO4。
请回答下列问题:
(1)副产品甲是____________,可循环利用的物质是___________________________。
(2)上述生产流程中加入铁屑的目的是_______________________________________。
(3)写出中间产品乙与焦炭、氯气在高温下发生反应的方程式为:________________。
(4)“硫酸法”生产钛排放的废液对水体有哪些污染,请指出主要的两点:
①_________________________________;②_______________________________。
针对其中一项污染,提出处理的方法: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省怀化市高三第三次模拟考试理综化学试卷(解析版) 题型:选择题
短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等。则下列说法正确的是
A.B与A只能形成化合物BA3
B.C的原子半径、离子半径均分别小于D的原子半径、离子半径
C.A、B、C形成的化合物可能促进水的电离,也可能抑制水的电离
D.A、D均能与C形成原子个数比为1︰1、2︰1的化合物,且A2C2与D2C2的化学键类型相同
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省岳阳市高三教学质量检测二理综化学试卷(解析版) 题型:选择题
下列对实验现象的解释与结论正确的是
编号 | 实验操作 | 实验现象 | 解释与结论 |
A | 向某溶液中加入BaCl2溶液 | 有白色沉淀产生 | 生成了难溶于水的BaSO4, 该溶液中一定含有SO42- |
B | 向鸡蛋清溶液中, 加入饱和(NH4)2SO4溶液 | 有白色沉淀产生 | 蛋白质发生了盐析 |
C | 向甲苯中滴入少量浓溴水, 振荡,静置 | 溶液分层,上层呈橙红色,下层几乎无色 | 甲苯和溴水发生取代反应, 使溴水褪色 |
D | 向蔗糖中加入浓硫酸 | 变黑,放热,体积膨胀,放出刺激性气体 | 浓硫酸具有吸水性和强氧化性, 反应中生成C、SO2和CO2等 |
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省五市十校高一下学期期中教学质量检测化学试卷(解析版) 题型:计算题
把3molA和2.5molB混合于2L密闭容器中,发生反应:
3A(g)+B(g) xC(g)+2D(g),5min后反应达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L.min).求:
xC(g)+2D(g),5min后反应达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L.min).求:
(1) x= ;
(2) 平衡时C的浓度为多少?(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省五市十校高一下学期期中教学质量检测化学试卷(解析版) 题型:选择题
关于如图所示装置的叙述,正确的是
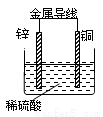
A.锌是正极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南师大附中第二学期期中考试高一化学试卷(解析版) 题型:选择题
在一定温度下,反应A2(g) + B2(g) 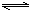 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
A、单位时间内生成nmolA2同时生成nmolAB
B、容器内的总物质的量不随时间变化
C、单位时间内生成2nmolAB的同时生成nmolB2
D、单位时间内生成nmolA2的同时生成nmolB2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com