
【题目】已知有机物: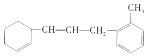 。
。
(1)该物质苯环上的一氯代物有___种。
(2)1mol该物质和足量溴水混合,消耗Br2的物质的量为___mol。
(3)下列说法不正确的是___(填序号)。
A.该有机物可发生加成、取代、氯化等反应
B.该有机物和甲苯属于同系物
C.该有机物使溴水褪色的原理与乙烯相同
D.该有机物能使酸性KMnO4溶液褪色,发生的是加成反应
【答案】4 2 BD
【解析】
(1)该物质苯环上有4种氢原子,苯环上有几种氢原子其苯环上一氯代物就有几种;
(2)碳碳双键能和溴发生加成反应;
(3) A.该有机物中含有碳碳双键、苯环,具有烯烃、苯的性质;
B.该有机物含有碳碳双键且含有苯环;
C.含有碳碳双键的物质具有烯烃的性质;
D.碳碳双键能被酸性高锰酸钾溶液氧化。
(1)该物质苯环上的4个氢原子都可被Cl原子取代而得到4种不同的产物,则一氯代物有4种;
(2)碳碳双键能与溴发生加成反应,1mol该物质有2mol碳碳双键,可与与2mol![]() 反应;
反应;
(3)A.此物质含有碳碳双键,可发生加成、氧化等反应,苯环可发生取代反应,故A正确;
B.含有碳碳双键,与甲苯结构不同,和甲苯不属于同系物,故B错误;
C.含有碳碳双键,使溴水褪色的原理与乙烯相同,故C正确;
D.碳碳双键能被酸性高锰酸钾溶液氧化,能使酸性KMnO4溶液褪色,故D错误;
答案选BD。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】常温下两种不同浓度的NaOH溶液,c(H+)分别为1×10-13 mol/L和1×10-10 mol/L。将此两溶液等体积混合后,所得溶液中的c(H+)是( )
A.1×(10-14+10-10) mol/LB.![]() mol/L
mol/L
C.2×10-13 mol/LD.2×10-14 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如下反应:
①3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O | ②H++OH-=H2O |
③2Fe+3Cl2 | ④NaHCO3+NaOH=Na2CO3+H2O |
⑤CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 | ⑥NaClO+CO2+H2O=HClO+NaHCO3 |
⑦2Al+2NaOH+2H2O=2NaAlO2+3H2↑ | ⑧CO2+H2O=H2CO3 |
请回答:
(1)上述反应中有电子转移的是___(填序号),因此该类反应属于__反应。
(2)反应⑤的离子方程式是__。
(3)上述反应中属于复分解反应的是__(填序号)。复分解反应发生的条件是i.生成沉淀,ii.放出气体,iii.生成水等难电离物质,若要由反应印证i、ii、iii,则除了这几个反应外,请补充反应:_(写一个符合条件的化学方程式或离子方程式)。
(4)由反应①及所学知识判断:在该反应发生的条件下,NO3-、H+、Cu2+的氧化性由大到小的顺序是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香料甲和G在生活中有很多用途,工业上利用有机物A(![]() )来制备,其合成路线如图:
)来制备,其合成路线如图: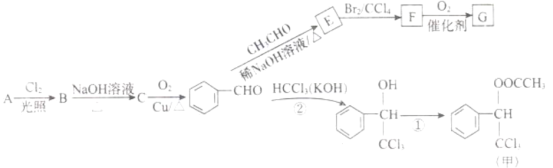
已知:![]()
![]()
![]()
![]() 、
、![]() 代表烃基或氢原子
代表烃基或氢原子![]()
回答下列问题:
(1)C的名称是______,F中官能团的名称是______。
(2)②的反应类型是______,E的结构简式为______。
(3)下列关于E的叙述正确的是______。
A.分子式为![]()
B. 1mol最多能与![]() 发生加成反应
发生加成反应
C. 自身能发生加聚、缩聚反应
D. 最多有9个碳原子位于同一平面
(4)C有多种同分异构体,其中属于芳香族化合物的有______种。
(5)写出反应①的化学方程式______。
(6)F的同分异构体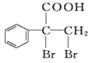 是一种重要的药物中间体,其合成路线与G相似,请以为原料设计它的合成路线
是一种重要的药物中间体,其合成路线与G相似,请以为原料设计它的合成路线![]() 其他所需原料自选
其他所需原料自选![]() 。____________
。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)室温下,0.1mol/L的亚硝酸(HNO2)、次氯酸的电离常数Ka分别为:7.1×10-6,2.98×10-9。HNO2的酸性比HClO_______(填“强”、“弱”);将0.1mol/L的亚硝酸加水稀释100倍,c(H+)_______(填“不变”、“增大”或“减小”),Ka值________(同上)
(2)NaNO2与NaCl都是白色粉末且都有咸味,但NaNO2有毒,具有致癌性。通常它们可以通过加入热的白醋(CH3COOH)鉴别,NaNO2遇到白醋会产生一种红棕色气体和一种无色气体,它们的组成元素相同。该反应的离子方程式为____________。
(3)磷及部分重要化合物的相互转化如图甲所示。
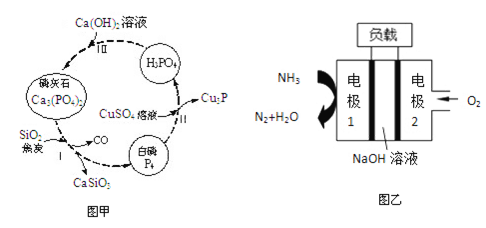
①“步骤Ⅰ”为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,焦炭的作用是__________。
②不慎将白磷沾到皮肤上,可用0.2mol/LCuSO4溶液冲洗,“步骤Ⅱ”涉及的反应中氧化剂是_________。
(4)若处理后的废水中c(PO43-)=4×10-7mol/L,则溶液中c(Ca2+)不会超过________mol/L。(Ksp[Ca2(PO4)3]=2×10-29)
(5)某“液氨—液氧”燃料电池装置示意图如图乙所示,该燃料电池以NaOH为电解质。该电池在工作时,“电极2”为_______极(填“正”或“负”);“电极1”表面发生的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图。又知AgCl的Ksp=1.8×10-10。下列说法不正确

A.t°C时,Ag2CrO4的Ksp为1×10-8
B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C.t°C时,Y点和Z点的Ag2CrO4的Ksp相等
D.t°C时,将0.01 mol·L-1AgNO3溶液滴入20 mL 0.01 mol·L-1KCl和0.01 mol·L-1K2CrO4的混合溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水存在如下电离:H2O![]() H++OH- H>0,下列叙述正确的是
H++OH- H>0,下列叙述正确的是
A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小
B.将水加热,Kw增大,pH减小
C.向水中加入少量固体NH4Cl,平衡逆向移动,c(H+)降低
D.向水中加入少量固体硫酸钠,c(H+)=10-7mol/L,Kw不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用已知物质的量浓度的NaOH测定未知物质的量浓度的盐酸,将20.00 ![]() 待测盐酸放入锥形瓶中,并滴加2-3滴酚酞作指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2-3次,记录数据如下。
待测盐酸放入锥形瓶中,并滴加2-3滴酚酞作指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2-3次,记录数据如下。
实验编号 |
| 滴定完成时, | 待测盐酸的体积/ |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
① 滴定达到终点的标志是____________________________。
② 根据上述数据,可计算出该盐酸的浓度约为_______(保留两位有效数字)。
③ 排除碱式滴定管中气泡的方法应采用如图所示操作中的________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

④ 在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有________(填字母序号)。
A. 滴定终点读数时俯视
B. 酸式滴定管使用前,水洗后未用待测盐酸润洗
C. 锥形瓶水洗后未干燥
D. 称量的![]() 固体中混有
固体中混有![]() 固体
固体
E. 碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-QkJ·mol1(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) ΔH=-QkJ·mol1(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
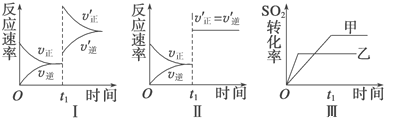
A. 图Ⅰ研究的是t1时刻增大O2的浓度对反应速率的影响
B. 图Ⅱ研究的是t1时刻加入催化剂后对反应速率的影响
C. 图Ⅲ研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com