
【题目】为探究某无结晶水的正盐X(仅含有两种短周期元素)的组成和性质,设计并完成下列实验。(气体体积已转化为标准状况下的体积)
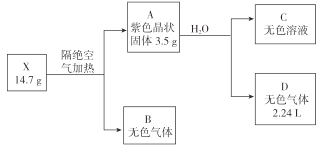
已知:B是空气的主要成分之一;C是一种强碱,且微溶于水 ,载人宇宙飞船内常用含 C的过滤网吸收宇航员呼出的CO2,以净化空气;D遇湿润的红色石蕊试纸变蓝。
(1)X的化学式为 __________________ 。
(2)图中B的组成元素在元素周期表中的位置是______________。
(3)A的电子式为 ____________。
(4)X受热分解转变成 A 和 B 的化学反应方程式为 ____________。
【答案】LiN3 第2周期VA族 ![]() 3LiN3
3LiN3![]() Li3N+4N2↑
Li3N+4N2↑
【解析】
B是空气的主要成分之一,B为氮气或氧气;C是一种强碱,且微溶于水,C为LiOH,载人宇宙飞船内常用含 C的过滤网吸收宇航员呼出的CO2,以净化空气,LiOH与反应生成Li2CO3;D遇湿润的红色石蕊试纸变蓝,D是NH3,确定B为氮气,NH3是2.24L合0.1mol,A中N为14g·mol-1×0.1mol=1.4g。A为Li3N,3.5g中Li为3.5-1.4=2.1g,14.7gX中Li为 2.1g,n(Li)=![]() =0.3mol,n(N)=
=0.3mol,n(N)=![]() =0.9mol,n(Li):n(N)=0.3:0.9=1:3,X的化学式为:LiN3。
=0.9mol,n(Li):n(N)=0.3:0.9=1:3,X的化学式为:LiN3。
(1)由分析可知:X的化学式为LiN3。故答案为:LiN3;
(2)B为氮气,组成元素N在元素周期表中的位置是第2周期VA族。故答案为:第2周期VA族;
(3)A为Li3N,Li最外层只有1个电子,显+1价,N最外层5个电子,得三个电子,显-3价,电子式为![]() 。故答案为:
。故答案为:![]() ;
;
(4)由分析X的化学式为:LiN3,X受热分解转变成 Li3N 和 N2,由质量守恒:化学反应方程式为 3LiN3![]() Li3N+4N2↑。故答案为: 3LiN3
Li3N+4N2↑。故答案为: 3LiN3![]() Li3N+4N2↑。
Li3N+4N2↑。


科目:高中化学 来源: 题型:
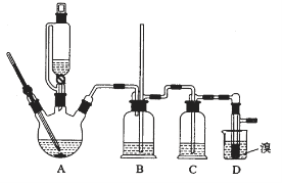
【题目】实验室制备1,2—二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。
用少量溴和足量的乙醇制备1,2—二溴乙烷的装置如图所示:
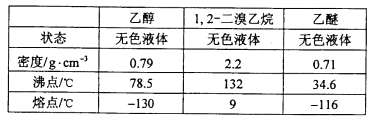
有关数据列表如下:
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是________;(填正确选项前的字母)
a. 引发反应 b. 加快反应速度
c. 防止乙醇挥发 d. 减少副产物乙醚生成
(2)在装置C中应加入________,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a 水 b 浓硫酸 c 氢氧化钠溶液 d 饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的方法是D装置中____________________________;
(4)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,溶液分层,产物应在______层(填“上”“下”);分离该有机物的方法叫_______________。
(5)若产物中有少量乙醚生成,最好用__________除去;(填正确选项前的字母)
a蒸发 b 蒸馏 c 重结晶
(6)反应过程中应用冷水冷却装置D,其主要目的是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的不可能是
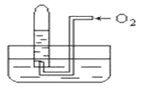
A.NO2一种气体B.O2与NO2的混和气体
C.NO与NO2的混和气体D.N2与NO2的混和气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(1)从3 min到9 min,υ(CO2)=______mol·L-1·min-1
(2)能说明上述反应达到平衡状态的是____________(填编号)
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的压强不随时间的变化而变化
C.单位时间内生成1 mol H2,同时生成1 mol CH3OH
D.混合气体的平均相对分子质量不随时间的变化而变化
(3)平衡时CO2的转化率为________%
(4)平衡混合气体中CO2(g)和H2(g)的质量之比是____________。
(5)第3 min时υ正(CH3OH)___________第9 min时υ逆(CH3OH)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲苯与浓硫酸、浓硝酸在100℃时能获得不溶于水的淡黄色针状晶体,请写出反应方程式:__________。上述反应是加成反应还是取代反应?请判断并说明原因:__________________。
(2)Mg3N2是离子化合物,各原子均满足8电子稳定结构,写出Mg3N2的电子式:__________。
(3)在常压下,乙醇在水中的溶解度比溴乙烷在水中的溶解度大,主要原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素在农业、医药等诸多领域应用广泛。工业上有多种工艺用NH3和CO2直接合成尿素。
(1)水溶液全循环法合成尿素的反应过程可用下列热化学方程式表示:
反应I 2NH3(1) +CO2(g)NH2 COONH4(1) △H1 = - 119.2 kJmol-1
反应II NH2COONH4(1)CO(NH2)2(1)+ H2O(1) △H2= 15.5 kJmol-1
①写出NH3(1)与CO2(g)反应生成CO(NH2)2(1)和液态水的热化学方程式:______。
②该工艺要求在190~ 200℃、13 ~ 24 MPa 的条件下反应,90℃左右反应可实现最高平衡转化率。试解释选择高压条件的理由:_________。
(2)在不同氨碳比L=![]() 和水碳比W=
和水碳比W=![]() 条件下CO2平衡转化率x随温度T变化情况如图所示:
条件下CO2平衡转化率x随温度T变化情况如图所示:

①CO2平衡转化率x随温度T升高先增大后减小,试分析原因:_________。
②在图中,画出L=4、W=O时CO2平衡转化率x随温度T变化的曲线示意图____。
(3)实验室模拟热气循环法合成尿素,T℃度时,将5.6mol NH3与5.2molCO2在容积恒定为0.5L的恒温密闭容器中发生反应:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O (g) △H1=—43kJmol-1。达到平衡状态时,NH3与CO2的平衡分压之比 p(NH3): p(CO2)= 2:13。[p(NH3)= x(NH3)p,x(NH3)为平衡体系中NH3的物质的量分数,p为平衡总压]。
①T ℃时,该反应的平衡常数 K = ______________。
②若不考虑副反应,对于该反应体系,下列说法正确的是 _________ 。
A.当反应体系中气体分子的平均摩尔质量保持不变时,反应达到平衡状态
B.相同条件下,提高水碳比或降低氨碳比都会使NH3 的平衡转化率降低
C.在容器中加入CaO,(可与 H2O反应),提高CO(NH2)2产率
D.反应开始后的一段时间内,适当升温可提高单位时间内CO2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法。
(1)目前,应用最广泛的烟气氮氧化物脱除技术是NH3催化还原法,化学反应可表示为:2NH3(g)+NO(g)+NO2(g)== 2N2(g)+3H2O(g)△H<0
①该反应中,反应物总能量_______(填“>”、“<”或“=”)生成物总能量。
②当该反应有2mol N2(g)生成时,转移电子的物质的量为________mol。
③该反应中,还原剂为_______(填化学式),氧化产物与还原产物的质量比为_______。
(2)也可以利用甲烷催化还原氮氧化物,已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol ;CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H2=-867kJ/mol
则CH4(g)将NO(g)还原为N2(g)的热化学方程式是_______。
(3)锌锰干电池是应用最普遍的电池之一(如图所示),总反应方程式为: Zn+2MnO2+2NH4Cl=ZnCl2+2NH3↑+Mn2O3+H2O
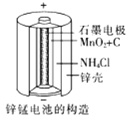
①锌锰干电池的负极材料是________,
②负极发生的电极反应方程式为:_______
③正极发生的电极反应方程式为:________。
④若反应消耗32.5 g负极材料,则电池中转移电子的数目为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,不合理的是( )

A. 用a趁热过滤提纯苯甲酸B. 用b制备并检验乙烯
C. 用c除去溴苯中的苯D. 用d分离硝基苯与水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核电站遭破坏,会造成放射性物质![]() I和
I和![]() Cs向外界泄漏。下列有关说法错误的是( )
Cs向外界泄漏。下列有关说法错误的是( )
A.每个![]() Cs含有78个中子
Cs含有78个中子
B.CsOH的碱性比KOH的强
C.HI的还原性比HF的强
D.KIO3是碘的最高价含氧酸的盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com