
 有多种同分异构体,其中属于酯类且含有苯环结构的共有( )
有多种同分异构体,其中属于酯类且含有苯环结构的共有( )| A. | 7种 | B. | 6种 | C. | 5种 | D. | 4种 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
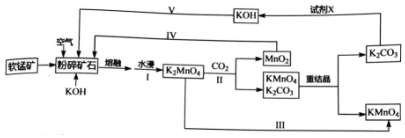
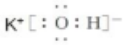 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
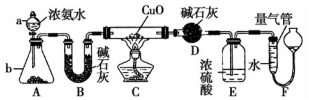 某课外活动小组欲利用CuO与NH4反应,研究NH3的某种性质并测定其组成,设计了如图实验装置(夹持装置未画出)进行实验.请回答下列问题:
某课外活动小组欲利用CuO与NH4反应,研究NH3的某种性质并测定其组成,设计了如图实验装置(夹持装置未画出)进行实验.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
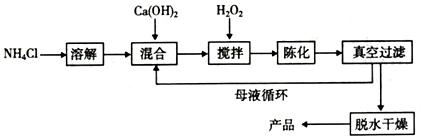
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
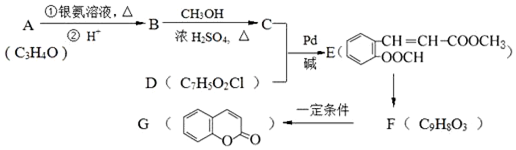

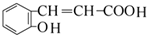 .
.
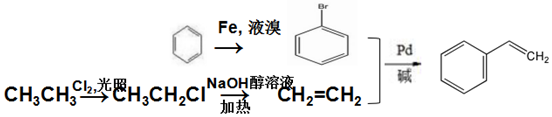 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
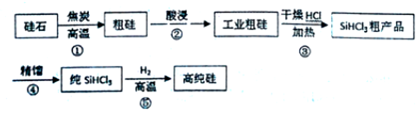
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水跟过量CO2气体反应:Ca(OH)2+CO2=CaCO3↓+H2O | |
| B. | 稀硫酸与Cu反应:2H++Cu=Cu2++H2↑ | |
| C. | 腐蚀法制作印刷线路板:2Fe3++Cu=2Fe2++Cu2+ | |
| D. | 铁粉加入AgNO3溶液中:Fe+Ag+=Fe2++Ag |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com