
˫ָʾ�����������ⶨ�����к���NaOH��NaHCO3��Na2CO3�е�һ�ֻ��������ʵĺ������������������������Һ�м����̪���ñ�����ζ�����NaOH��Na2CO3ת��ΪNaCl��NaHCO3ʱ����Һ��Ϊ��ɫ������V1mL���ᡣȻ��μӼ��ȣ������ñ�����ζ�����NaHCO3ת��ΪNaClʱ����Һ�ɻ�ɫ��Ϊ��ɫ������V2mL���ᡣ
��1���Ը����±�������V1��V2�����ݷ�Χ�ж�ԭ�����ijɷ֣��û�ѧʽ��ʾ����
��2������ȡ�����ʵ�����1.200g�����ʲ���HCl��Ӧ�����Ƴ�100.0mLˮ��Һ��ȡ��20.00mL����0.1000mol/L������ζ������V1=35.00mL��V2=5.00mL���������ijɷּ����ɷֵ�����������
��������1����̪�Ǽ��������±�ɫ��ָʾ��������ɫ�պ���ȥʱ����Ӧ�Ļ�ѧ����ʽΪ��
NaOH+HCl=NaCl+H2O
Na2CO3+HCl=NaCl+NaHCO3
���ü�����ָʾ���������ζ�����Һ�ɻ�ɫ��Ϊ��ɫʱ����Ӧ�Ļ�ѧ����ʽΪ��
NaHCO3+HCl=NaCl+CO2��+ H2O
����V1��V2�Ĵ�С���ж������ijɷ֣����±���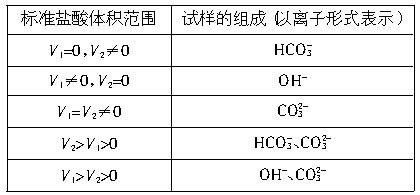
����ж�������ɷֱ�ΪNaHCO3��NaOH��Na2CO3��Na2CO3��NaHCO3��NaOH��Na2CO3��
��2�����ݣ�1�����жϣ���֪����������Ҫ�ɷ�ΪNaOH��Na2CO3����20.00mL������Һ�У�
n��Na2CO3��=cV2=0.1000mol/L��5.00��10-3L=5.00��10-4mol
n��NaOH��=c��V1-V2��=0.1000mol/L��30.00��10-3L=3.00��10-3mol
��ԭ������NaOH��Na2CO3�����������ֱ�Ϊ��
�أ�NaOH��=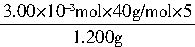 ��100%=50.00%
��100%=50.00%
�أ�Na2CO3��=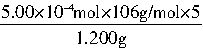 ��100%=22.08%
��100%=22.08%


 Ӧ������ҵ��ϵ�д�
Ӧ������ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
˫ָʾ�����������ⶨNaOH��NaHCO3��Na2CO3�е�һ�ֻ�����������ɵĻ����ĺ����������ǣ��������Һ�мӷ�̪���ñ�����ζ�����NaOH��Na2CO3��ת��ΪNaCl��NaHCO3ʱ����̪�ɺ�ɫ��Ϊ��ɫ������V1 mL���ᣬȻ��μӼ��ȣ�����������ζ�����NaHCO3ת��ΪNaClʱ����Һ�ɻ�ɫ��Ϊ��ɫ������V2 mL���ᡣ
˼����(1)�����Ϸ������±�5���������ԣ��Ը�����������ȷ���١��ݵijɷ֡�
���� | �� | �� | �� | �� | �� |
���������� | V1��V2 ��V2��0 | V1��V2 ��V1��0 | V1��V2 ��V2��0 | V1��V2��0 | V2��V1��0 |
�����ɷ� |
|
|
|
|
|
(2)����ȡ����������1.2 g(���ʲ������ᷴӦ)�����Ƴ�100 mLˮ��Һ��ȡ��20 mL����0.1 mol��L��1����ζ������V1��35 mL��V2��5 mL���������ijɷּ�������������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com