
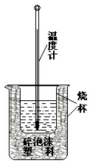
 50ml 0.50mol•L-1������50mL 0.55mol•L-1NaOH��Һ������ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ�����зų��������ɼ����к��ȣ��ش��������⣺
50ml 0.50mol•L-1������50mL 0.55mol•L-1NaOH��Һ������ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ�����зų��������ɼ����к��ȣ��ش��������⣺���� ��1���������ȼƵĹ������жϸ�װ�õ�ȱ������������Ӳֽ�壬δ��ַ�Ӧ������һ��������ɢʧ��
��2������Ũ����ϡ��ʱҪ�ų�����������
��� �⣺��1�������ȼƵĹ����֪��װ�õ�ȱ�������ǣ��ٻ��β�����������Ӳֽ�壨�ǰ壩��������Ӳֽ�壬����һ��������ɢʧ�����û��β����������裬δ��ַ�Ӧ���ų�����ƫС�����ߵ�������¶ȶ���ƫС���к�����ֵ�����С��
�ʴ�Ϊ�����β���������Ӳֽ�壨�ǰ壩��ƫС��ƫС��
��2��Ũ����ϡ��ʱҪ�ų��������¶����ߣ�����Ӧ�ų�������ƫ�����õ��к��ȵ���ֵ��ƫ�ߣ�
�ʴ�Ϊ��ƫ�ߣ�����Ũ��������ˮ���ȣ�
���� ���⿼�����к��ȵIJⶨ��������Ŀ�Ѷ��еȣ���ȷ�к��ȵIJⶨԭ��Ϊ���ؼ�������������ѧ���ķ�����������ѧʵ��������


 �Ƹ�360�ȶ����ܾ�ϵ�д�
�Ƹ�360�ȶ����ܾ�ϵ�д� ���⿼����Ԫ���Ծ�ϵ�д�
���⿼����Ԫ���Ծ�ϵ�д� ��У���˳�̾�ϵ�д�
��У���˳�̾�ϵ�д� ��У���һ��ͨϵ�д�
��У���һ��ͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
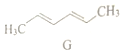
| A�� | ����ʽΪC6H10 | B�� | ����ϩ��ͬϵ�� | ||
| C�� | ���Է����ӳɷ�Ӧ | D�� | ������ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
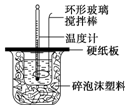 ijʵ��С�������50mL 1.0mol/L�����50mL 1.1mol/L ����������Һ����ͼװ���н����кͷ�Ӧ���ڴ��ձ��ײ�������ĭ���ϣ���ֽ������ʹ�����С�ձ���������ձ�������ƽ��Ȼ�����ڴ�С�ձ�֮����������ĭ���ϣ���ֽ���������ձ�������ĭ���ϰ壨��Ӳֽ�壩���ǰ壬�ڰ��м俪����С�ף�����ʹ�¶ȼƺͻ��β��������ͨ����ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��Իش��������⣺
ijʵ��С�������50mL 1.0mol/L�����50mL 1.1mol/L ����������Һ����ͼװ���н����кͷ�Ӧ���ڴ��ձ��ײ�������ĭ���ϣ���ֽ������ʹ�����С�ձ���������ձ�������ƽ��Ȼ�����ڴ�С�ձ�֮����������ĭ���ϣ���ֽ���������ձ�������ĭ���ϰ壨��Ӳֽ�壩���ǰ壬�ڰ��м俪����С�ף�����ʹ�¶ȼƺͻ��β��������ͨ����ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��Իش��������⣺| ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶ȣ�t2��/�� | �²t2-t1��/�� | ||
| ���� | NaOH��Һ | ƽ��ֵ | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
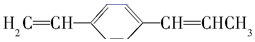 ��˵����ȷ���ǣ�������
��˵����ȷ���ǣ�������| A�� | ����ԭ�Ӷ���ͬһƽ���� | |
| B�� | �����4��̼ԭ����ͬһֱ���� | |
| C�� | ��7��̼ԭ�ӿ�����ͬһֱ���� | |
| D�� | ���ֻ����9��̼ԭ����ͬһƽ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
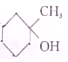 ��ͬ���칹�壮�ҷ�����ֻ�����ٲ�ͬ��ѧ�������⣮д���û�����Ľṹ��ʽ
��ͬ���칹�壮�ҷ�����ֻ�����ٲ�ͬ��ѧ�������⣮д���û�����Ľṹ��ʽ ��
�� ����дһ�֣�
����дһ�֣��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
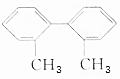 ����������пհף�
����������пհף��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
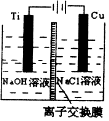 ����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע����Ϊ��ȡCu2O�����ַ�����
����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע����Ϊ��ȡCu2O�����ַ�����| ������ | ��̿���ڸ��������»�ԭCuO |
| ������ | ��ⷨ��2Cu+H2O$\frac{\underline{\;���\;}}{\;}$ Cu2O+H2�� |
| ������ | ���£�N2H4����ԭ����Cu��OH��2 |
| ��� | 0 | 10 | 20 | 30 | 40 | 50 | |
| �� | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| �� | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| �� | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com