
 ×0.2mol/L=0.1mol/L,由离子方程式Al3++4OH-=AlO2-+2H2O可知,此时溶液中c(AlO2-)=
×0.2mol/L=0.1mol/L,由离子方程式Al3++4OH-=AlO2-+2H2O可知,此时溶液中c(AlO2-)= ×0.2mol/L×
×0.2mol/L× =0.025mol/L,由电荷守恒可知此时溶液中c(K+)=c(AlO2-)+2c(SO42-),原混合溶液中为反应后溶液中c(K+)的二倍.
=0.025mol/L,由电荷守恒可知此时溶液中c(K+)=c(AlO2-)+2c(SO42-),原混合溶液中为反应后溶液中c(K+)的二倍. ×0.2mol/L=0.1mol/L,由离子方程式Al3++4OH-=AlO2-+2H2O可知,此时溶液中c(AlO2-)=
×0.2mol/L=0.1mol/L,由离子方程式Al3++4OH-=AlO2-+2H2O可知,此时溶液中c(AlO2-)= ×0.2mol/L×
×0.2mol/L× =0.025mol/L,由电荷守恒可知此时溶液中c(K+)=c(AlO2-)+2c(SO42-)=0.025mol/L+2×0.1mol/L=0.225mol/L,所以原混合溶液中为反应后溶液中c(K+)为0.225mol/L×2=0.45mol/L.
=0.025mol/L,由电荷守恒可知此时溶液中c(K+)=c(AlO2-)+2c(SO42-)=0.025mol/L+2×0.1mol/L=0.225mol/L,所以原混合溶液中为反应后溶液中c(K+)为0.225mol/L×2=0.45mol/L.

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原来混合溶液中Al2(SO4)3和MgSO4的物质的量浓度之比为( )
在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原来混合溶液中Al2(SO4)3和MgSO4的物质的量浓度之比为( )查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
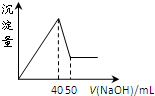 在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )
在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )| A、1:3 | B、1:2 | C、1:1 | D、2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com