
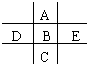
 如图为周期表的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高正价是最低负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题:
如图为周期表的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高正价是最低负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题: .
. .
. 分析 B元素的最高正价是最低负价绝对值的3倍,则最高正价为+6价,它的最高氧化物为BO3,其中含氧60%,设B的相对原子质量为M,则有$\frac{M}{M+16×3}$=40%,解得M=32,则B为S元素,可推知A为O元素,D为P元素,E为Cl元素,C为Se元素,根据元素周期律的递变规律判断对应化合物的性质.
解答 解:B元素的最高正价是最低负价绝对值的3倍,则最高正价为+6价,它的最高氧化物为BO3,其中含氧60%,设B的相对原子质量为M,则有$\frac{M}{M+16×3}$=40%,解得M=32,则B为S元素,可推知A为O元素,D为P元素,E为Cl元素,C为Se元素.
(1)同周期自左而右原子半径减小、同主族自上而下原子半径增大、电子层越多原子半径越大,故上述元素中O原子半径最小,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->Cl->O2-,
故答案为:O;S2->Cl->O2-;
(2)B、D、E最高氧化物对应水化物分别为:H2SO4、H3PO4、HClO4,同周期元素从左到右元素的非金属性逐渐增强,对应最高价氧化物的水化物的酸性逐渐增强,则酸性最强的为HClO4,
故答案为:H2SO4;H3PO4;HClO4; HClO4;
(3)A、B、C所形成气态氢化物H2O、H2S、H2Se,同主族元素从上到下元素的非金属性逐渐减弱,非金属性越强,对应的氢化物越稳定,则最稳定的是H2O,电子式为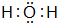 ,
,
故答案为:H2O;H2S;H2Se;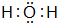 ;
;
(4)D为P元素,E为Cl元素,化合物中各原子最外层都满足8电子结构,则为PCl3,故答案为:PCl3;
(5)Cl2具有强氧化性,与H2S反应生成S和HCl,反应的方程式为H2S+Cl2=S+2HCl,故答案为:H2S+Cl2=S+2HCl;
(6)C为Br元素,处在长周期的第四周期ⅥA族,其原子结构简图为  ,故答案为:四;ⅥA;
,故答案为:四;ⅥA; .
.
点评 本题考查位置结构性质的相互关系,题目难度中等,注意根据元素在周期表中的位置结合化合价特点进行推断的方法.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 福尔马林可作食品的保鲜剂 | |
| B. | 苯酚有毒,但可用于杀菌消毒 | |
| C. | 聚乙烯塑料制品可用于食品的包装 | |
| D. | 食醋的主要成分是醋酸,它是一种弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Th元素的质量数是232 | B. | 230Th和232Th的化学性质相同 | ||
| C. | 232Th转化成233U是化学变化 | D. | Th元素的相对原子质量是231 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 汽车尾气中含有NO、CO和碳颗粒等有害物质,已成为某些大城市空气的主要污染源.
汽车尾气中含有NO、CO和碳颗粒等有害物质,已成为某些大城市空气的主要污染源. 2NO;汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,试分析其原因温度升高,反应速率加快.
2NO;汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,试分析其原因温度升高,反应速率加快.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③④ | C. | ①②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.08mol/L | B. | 0.08mol/(L•s) | C. | 0.04mol/(L•min) | D. | 0.04 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
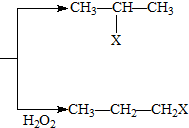 (X为卤素原子)
(X为卤素原子)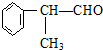 的物质,该物质是一种香料.
的物质,该物质是一种香料.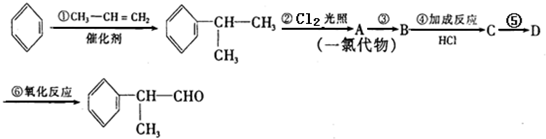
 .
.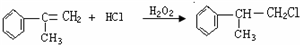 .
.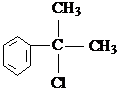 的水解产物
的水解产物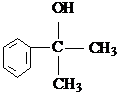 不能经氧化反应⑥而得到产品.
不能经氧化反应⑥而得到产品.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 试验编号 | 待测液的体积(mL) | 滴入0.4000mol•L-1盐酸的体积(mL) | |
| 滴定前(mL) | 滴定后(mL) | ||
| 1 | 20.00 | 2.10 | 22.00 |
| 2 | 20.00 | 0.90 | 21.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com