
原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1。下列有关X的说法中不正确的是( )
A.X能形成化学式为H2XO4的酸
B.X能与某些金属元素形成化合物
C.X原子的最外层电子数和核电荷数肯定为奇数
D.X可能形成化学式为KXO3的盐
科目:高中化学 来源:2015-2016学年山东省济宁市任城区高二下学期期中考试化学试卷(解析版) 题型:选择题
以2-丁烯为原料,通过一步反应(所需其它试剂自选)无法完成的是
A.2-丁醇 B.2,3-二氯丁烷 C.2-溴丁烷 D.2,3-丁二醇
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二下学期期中考试化学试卷(解析版) 题型:填空题
黄铁矿被称“愚人金”,化学成分是FeS2,晶体属正方体晶系的硫化物矿物。室温为非活性物质。温度升高后变得活泼。在空气中氧化成三氧化二铁和二氧化硫,主要用于接触法制造硫酸:

回答下列问题:
(1)在FeS2中的S2-的核外电子排布式是________________________;
(2)常温下Fe3+比Fe2+要更加稳定的原因是__________________________________;
(3)将FeS2与稀盐酸反应得到H2S2,H2S2分子中,共价键的类型是___________________;FeS2氧化得到SO2,在SO2分子中的S原子的杂化轨道类型是______________________ ,写出两个与SO2互为等电子体的分子或离子_______________________。-
(4)H2SO4和H2SO3都是S的含氧酸,请用结构知识解释H2SO4比H2SO3酸性强的原因:
_____________________________________________________________________。
(5)FeS2的晶体中的Fe2+离子的排列方式如下图。
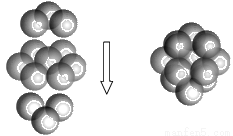
①每个Fe2+周围最近的等距离的S22-离子有____________个。
②已知FeS2的晶胞参数是a0=0.54nm,它的密度为_____________________g·cm-3(列式并计算,阿伏加德罗常数为6.02×1023)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二下学期期中考试化学试卷(解析版) 题型:选择题
已知次氯酸分子的结构式为H﹣O﹣Cl,下列有关说法正确的是( )
A.依据其结构判断该含氧酸为强酸
B.O原子与H、Cl都形成σ键
C.该分子为直线形非极性分子
D.该分子的电子式是H:O:Cl
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省十三校高一下学期期中考试化学试卷(解析版) 题型:填空题
为清理路面积雪人们使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
(1)X元素在元素周期表中的位置,该融雪剂的化学式是________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是________;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,电子式为________。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中加热时生成的产物的电子式为________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省十三校高一下学期期中考试化学试卷(解析版) 题型:选择题
已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,下列叙述不正确的是( )
A.原子半径B>A>C>D B.原子序数 a >b>c> d
C.离子半径C3->D->B+>A2+ D.离子的还原性C3->D-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省十三校高一下学期期中考试化学试卷(解析版) 题型:选择题
下列关于化学键的说法正确的是( )
①含有金属元素的化合物一定是离子化合物 ②第IA族和第ⅦA族原子化合时,一定生成离子键 ③由非金属元素形成的化合物一定不是离子化合物 ④活泼金属与非金属化合时,能形成离子键 ⑤离子键就是阴、阳离子间的相互引力 ⑥含有离子键的化合物一定是离子化合物 ⑦离子化合物中可能同时含有离子键和共价键
A.①②⑤ B.④⑥⑦ C.①④③ D.②③⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一下学期期中考试化学试卷(解析版) 题型:选择题
下列反应过程中的能量变化情况符合右图的是

A.铝热反应
B.氧化钙和水反应
C.C+H2OCO+H2
D.一氧化碳气体的燃烧
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一下学期第一次月考化学试卷(解析版) 题型:填空题
填空题
(1)已知断裂1 mol C-H, O=O,C=O,H-O化学键所需能量分别为a KJ,bKJ,cKJ,dKJ,则该反应CH4 + O2 = CO2 + 2H2O 的反应热为ΔH= kJ·mol-1
(2)N2H4是一种高效清洁的火箭燃料,0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则该反应的热化学方程式是 。
(3) 某元素的一种核素X的质量数为A,含有N个中子,则ag 1HmX分子中所含质子数是
某元素的一种核素X的质量数为A,含有N个中子,则ag 1HmX分子中所含质子数是
(4)试比较下列三组ΔH的大小(填“>”、“<”或“=”)
A.A(g)+B(g) = C(g) ΔH1<0 A(g)+B(g) = C(l) ΔH2<0 则ΔH1____ΔH2
B.S(g)+O2(g) = SO2(g)ΔH1<0 S (s)+O2(g) = SO2(g) ΔH2<0 则ΔH1____ΔH2
C.C(s)+O2(g) = CO2(g)ΔH1<0 C(s)+O2(g) = CO(g) ΔH2<0 则ΔH1____ΔH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com