
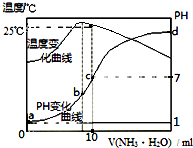
| A. | a点KW=1.0×10-14 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| D. | 25℃时,一水合氨的电离平衡常数为$\frac{1{0}^{-7}}{(10n-1)}$(用n表示) |
分析 A.根据图象可知,a点时溶液温度小于25℃,则水的离子积小于1.0×10-14 mol2•L-2;
B.b点时溶液温度最高,说明氨水与盐酸恰好反应,则b点溶质为氯化铵,铵根离子促进了水的电离,则此时水的电离程度最大;由于d点溶液pH未知,则无法判断a、d两点水的电离程度大小;
C.该关系c(NH4+)>c(Cl-)>c(H+)>c(OH-)不满足电荷守恒;
D.25℃时溶液的pH=7,则c(H+)=c(OH-)=10-7 mol•L-1,c(NH4+)=c(Cl-)=0.05mol/L,根据物料守恒可知:c(NH3•H2O)=(0.5n-0.05)mol/L,然后结合铵根离子的水解平衡常数表达式计算.
解答 解:A.水的离子积与温度有关,a点时溶液温度小于25℃,则水的离子积Kw<1.0×10-14 mol2•L-2,故A错误;
B.b点溶液温度最高,说明此时两溶液恰好反应生成氯化铵,铵根离子水解促进了水的电离,则a、d两点都抑制了水的电离,则b点水的电离程度最大;由于d点混合液的pH不知,则无法判断a、d两点水的电离程度大小,故B错误;
C.b点时溶液的pH<7,则c(H+)>c(OH-),根据电荷守恒可知:c(Cl-)>c(NH4+),溶液中正确的离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故C错误;
D.根据图象可知,25℃时溶液的pH=7,则:c(H+)=c(OH-)=10-7 mol•L-1,c(NH4+)=c(Cl-)=0.05mol/L,根据物料守恒可知:c(NH3•H2O)=(0.5n-0.05)mol/L,则25℃时NH4Cl水解常数为:K=$\frac{0.05×1{0}^{-7}}{(0.5n-0.05)}$=$\frac{1{0}^{-7}}{(10n-1)}$,故D正确;
故选D.
点评 本题考查了酸碱混合的定性判断及离子浓度大小比较,题目难度中等,涉及水的电离及其影响、酸碱混合的定性判断及溶液pH的计算、离子浓度大小比较、水解平衡常数的计算等知识,D为难点,注意掌握水解平衡常数的表达式及计算方法.


科目:高中化学 来源: 题型:选择题
| A. | KOH溶液与AlCl3溶液 | B. | NaAlO2溶液与盐酸 | ||
| C. | NaHCO3溶液与盐酸 | D. | Na2CO3溶液与盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、H+、NO3- | B. | Mg2+、Fe3+、H+、NO3- | ||
| C. | Fe3+、H+、NO3- | D. | Cu2+、H+、NO3- |
查看答案和解析>>
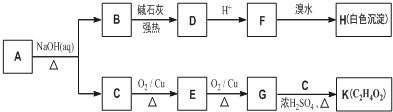
科目:高中化学 来源: 题型:解答题
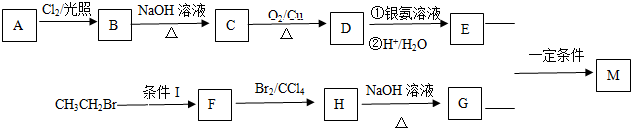
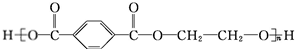 .
.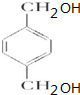 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$ +2H2O.
+2H2O.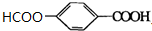 (写出所有可能的结构简式)
(写出所有可能的结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
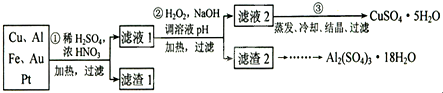
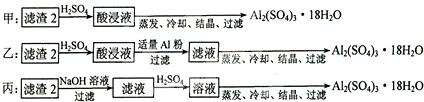
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.0g | B. | 11.7g | C. | 23.4g | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al | B. | Na | C. | Cu | D. | Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
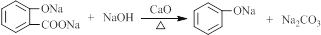 .
.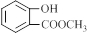 .
.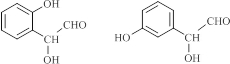 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com