
【题目】短周期主族元素X、Y、Z、W在周期表中的相对位置如图,四种元素的原子最外层电子数之和为20。下列说法正确的是
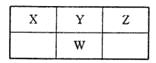
A.W位于第三周期ⅥA族
B.元素最高正价:Z>Y>X
C.简单气态氢化物稳定性:W>Y>X
D.工业上催化氧化Y的氢化物可用于制备其含氧酸
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】维生素A对人体,特别是对人的视力有重大作用,其结构简式如图所示:

下列关于该化合物的说法正确的是 ( )
A. 分子式为C16H25O
B. 含有苯环结构
C. 该物质1mol一定条件下最多能与3mol氢气反应
D. 分子中含有一种含氧官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语或描述中,不正确的有
①F-的结构示意图:![]()
②氢氧根的电子式:![]()
③HClO的结构式:H—Cl—O
④SO3的水溶液能导电,说明SO3是电解质
⑤NaHSO3在水中的电离方程式:NaHSO3=Na++H++SO32-
⑥同素异形体间的转化和同位素间的转化都是化学变化
A. 1项 B. 2项 C. 5项 D. 6项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴酸锂废极片中钴回收的某种工艺流程如下图所示,其中废极片的主要成分为钴酸锂(LiCoO2)和金属铝,最终可得到Co2O3及锂盐。
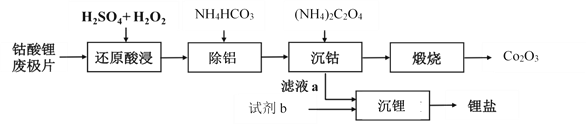
(1) “还原酸浸”过程中,大部分LiCoO2可转化为CoSO4,请将该反应的化学方程式补充完整:2LiCoO2+3H2SO4+□ ![]() □CoSO4+□ +□ + □ 。__________
□CoSO4+□ +□ + □ 。__________
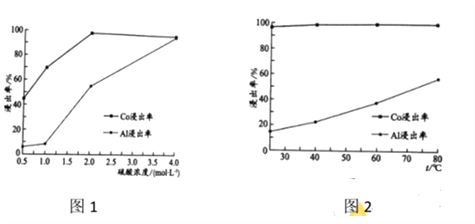
(2) “还原酸浸”过程中,Co、Al浸出率(进入溶液中的某元素质量占固体中该元素总质量的百分数)受硫酸浓度及温度(t)的影响分别如图1和图2所示。工艺流程中所选择的硫酸浓度为2 mol.L-1,温度为80 oC,推测其原因是________。
A. Co的浸出率较高 B. Co和Al浸出的速率较快
C. Al的浸出率较高 D. 双氧水较易分解
(3)加入(NH4)2C2O4后得CoC2O4沉淀。写出CoC2O4沉淀在空气中高温煅烧得到Co2O3的反应的化学方程式:________。
(4)若初始投入钴酸锂废极片的质量为1 kg,煅烧后获得Co2O3的质量为83 g,已知Co的浸出率为90%,则钴酸锂废极片中钴元素的质量分数约为________(小数点后保留两位)。
(5)已知“沉锂”过程中,滤液a中的c(Li+)约为10-1 mol·L-1,部分锂盐的溶解度数据如下表所示。
温度 | Li2SO4 | Li2CO3 |
0 oC | 36.1 g | 1.33 g |
100 oC | 24.0 g | 0.72 g |
结合数据分析,沉锂过程所用的试剂b是________(写化学式),相应的操作方法:向滤液a中加入略过量的试剂b,搅拌,________,洗涤干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于2甲基1丁烯[CH2=C(CH3)CH2CH3]的说法错误的是( )
A. 与1-丁烯(CH2=CHCH2CH3)互为同系物
B. 官能团有甲基、碳碳双键
C. 该有机物的所有碳原子可能共平面
D. 与环戊烷(![]() )互为同分异构体
)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将充满 NO2 和 O2 的试管倒立于水槽中,充分反应后,剩余气体体积为原混合气体体积的![]() ,则原混合气体中 NO2 和O2 的体积之比可能是( )
,则原混合气体中 NO2 和O2 的体积之比可能是( )
①8∶1 ②7∶3 ③7∶1 ④4∶1
A.①②B.①③
C.②③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.100 mol·L-1的NaOH溶液滴定20.00 mL 0.100 mol·L-1的HNO2溶液,![]() 与所加NaOH溶液体积的关系如图所示,下列说法错误的是( )
与所加NaOH溶液体积的关系如图所示,下列说法错误的是( )

A. 25 ℃时,0.100 mol·L-1的HNO2溶液的pH=2.75
B. B点对应的溶液中,2c(H+)+c(HNO2)=c(NO2-)+2c(OH-)
C. C点对应的溶液的pH=7,加入NaOH溶液的体积为20.00 mL
D. 滴定过程中从A到D点溶液中水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于 ( )

A. 锌和盐酸生成氢气
B. 二氧化锰和浓盐酸生成氯气
C. 碳酸钙和盐酸生成二氧化碳
D. 浓氨水和烧碱制取氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物和硫氧化物是常见的空气污染物,含氮氧化物和硫氧化物的尾气需处理后才能排放。
Ⅰ.氮氧化物的处理
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为_________。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为NO+NO2+2OH=2NO2-+H2O,2NO2+2OH= NO2-+NO3-+H2O,吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是_________(填化学式)。
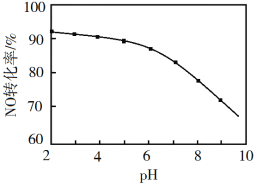
(3)NO的氧化吸收。在酸性NaClO溶液中,HClO氧化NO生成Cl和NO3-。其他条件相同,NO转化为NO3-的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。NaClO溶液的初始pH越小,NO转化率越高。其原因是_________。
Ⅱ.煤燃烧排放的烟气中SO2和NOx的处理
采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有SO2和NOx的烟气,反应温度为323K,NaClO2溶液浓度为5×103mol·L1 。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
(4)写出NaClO2溶液脱硫过程中主要反应的离子方程式________。增加压强,NO的转化率_________(填“提高”“不变”或“降低”)。
(5)由实验结果可知,脱硫反应速率大于脱硝反应速率。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com