
| A. | 检验某酸性溶液中Cl-和SO42-,选用试剂及顺序是过量Ba(NO3)2溶液、AgNO3溶液 | |
| B. | 将足量CO2和SO2的混合气体分别通入BaCl2溶液、Ba(NO3)2溶液中,最终都无沉淀生成 | |
| C. | 将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁 | |
| D. | 用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离 |
分析 A.检验氯离子用硝酸银溶液,检验硫酸根离子用钡离子,由于银离子能够与硫酸根离子反应,应该先检验硫酸根离子;
B.二氧化硫能够被硝酸根离子氧化成硫酸根离子,硫酸根离子与钡离子反应生成硫酸钡沉淀;
C.若铁粉不足,剩余的固体可能只有Cu,不含Fe;
D.加热NH4Cl固体和Ca(OH)2固体生成氨气、氯化钙和水,无法分离二者.
解答 解:A.检验某酸性溶液中Cl-和SO42-,由于硝酸银溶液能够与硫酸根离子反应,所以应该先加入硝酸钡溶液,后加入硝酸银,即选用试剂及顺序是过量Ba(NO3)2溶液、AgNO3溶液,故A正确;
B.将足量CO2和SO2的混合气体分别通入BaCl2溶液,不发生反应,所以无沉淀生成,若将CO2和SO2的混合气体通入Ba(NO3)2溶液中,由于酸性条件下硝酸根离子具有强氧化性,能够将二氧化硫氧化成硫酸,所以会生成硫酸钡沉淀,故B错误;
C.将铁粉加入FeCl3、CuCl2混合溶液中,铁离子优先反应,然后铜离子反应,充分反应后若有剩余的固体,且铁粉少量时剩余固体为铜,不含铁,故C错误;
D.NH4Cl固体和Ca(OH)2固体在加热条件下发生反应生成氨气,无法分离,故D错误;
故选A.
点评 本题考查了物质分离与提纯方法、常见离子的检验方法等知识,题目难度中等,明确常见离子的性质为解答关键,注意掌握物质分离与提纯方法的选择及应用,试题培养了学生的化学实验能力.


科目:高中化学 来源: 题型:填空题
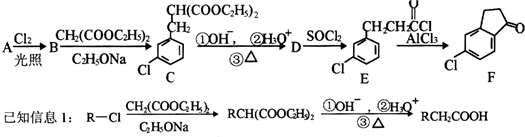
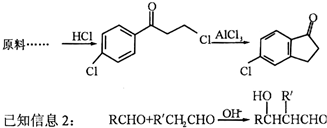
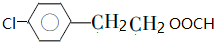 .
.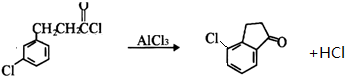 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe2+、SO32- | B. | Na+、K+、SO42- | C. | K+、SO42-、OH- | D. | Al3+、NO3-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无法判断固体中FeCl2是否存在 | |
| B. | ③中使高锰酸钾溶液褪色的是亚硝酸根离子 | |
| C. | B的pH<7 | |
| D. | 固体由Ba(OH)2、AlCl3、Na2SO3组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热23.15 kJ |
| ② | 0.6 | 1.8 | 0.8 | Q(Q>0) |
| A. | 容器①、②中反应的平衡常数相等 | |
| B. | 达平衡时,两个容器中XY3的物质的量浓度均为1mol•l-1 | |
| C. | 容器②中反应达到平衡时放出的热量为Q | |
| D. | 若将容器①体积缩小为0.40 L,则达平衡时放出的热量大于23.15 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6L | B. | 6.72L | C. | 2.8L | D. | 13.44L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ① | D. | ①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com