
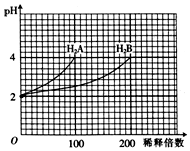
 常温下,取pH=2的两种二元酸H2A和H2B各1mL,分别加水稀释,测得溶液pH与加水稀释倍数关系曲线如图所示,则下列叙述正确的是( )
常温下,取pH=2的两种二元酸H2A和H2B各1mL,分别加水稀释,测得溶液pH与加水稀释倍数关系曲线如图所示,则下列叙述正确的是( )| A. | H2A的电离方程式为H2A?H++HA-、HA-?H++A2- | |
| B. | pH=4的NaHA水溶液中:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-) | |
| C. | 含NaHA、NaHB的混合溶液中,各离子浓度关系为c(Na+)=c(A2-)+c(HB-)+c(H2B)+c(B2-) | |
| D. | NaHB水溶液中,各离子浓度的大小顺序为c(Na+)>c(HB-)>c(OH-)>c(H+)>c(B2-) |
分析 A.根据图象知,H2A溶液稀释100倍,溶液pH由2增至4,说明H2A是强酸;而H2B溶液稀释200倍,溶液PH增加2个单位,说明H2B为弱酸;
B.溶液中存在电离平衡:HA-=H++A2-,不存在H2A、HA-;
C.根据NaHA和NaHB的混合液中的物料守恒分析;
D.H2B是弱酸,其NaHB水溶液,若HB-离子电离小于其水解呈碱性,若HB-离子电离大于其水解呈酸性,据此分析溶液中离子浓度大小.
解答 解:A.pH=2的H2A稀释100倍时溶液的pH变为4,说明该酸完全电离,所以为强酸,其电离方程式为H2A═2H++A2-,故A错误;
B.pH=4的NaHA水溶液中存在NaHA=Na++H++A2-、H2O?H++OH-,所以溶液呈存在粒子浓度大小顺序是c(H+)>c(Na+)=c(A2-)>c(OH-),故B错误;
C.NaHA中的物料守恒为:c(Na+)=c(A2-),NaHB中的物料守恒为:c(Na+)=c(HB-)+c(H2B)+c(B2-),二者结合可得:c(Na+)=c(A2-)+c(HB-)+c(H2B)+c(B2-),故C正确;
D.H2B是弱酸,其NaHB水溶液,若HB-离子电离小于其水解呈碱性,若HB-离子电离大于其水解呈酸性,溶液中离子浓度大小不能确定,故D错误;
故选C.
点评 本题考查了弱电解质的电离、离子浓度大小比较,题目难度中等,根据图象确定酸的强弱是解本题关键,再结合守恒思想分析解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol NH3所含有的原子数为NA | |
| B. | 常温常压下,22.4 L氧气所含的原子数为2NA | |
| C. | 常温常压下,48 g O3所含的氧原子数为3NA | |
| D. | 0.1 molNa+中所含的电子为1.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
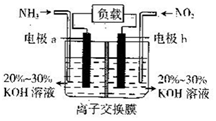 利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减少环境污染,又能充分利用化学能,装置如图所示.下列说正确是( )
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减少环境污染,又能充分利用化学能,装置如图所示.下列说正确是( )| A. | 电流从电极a经过负载后流向电极b | |
| B. | 为使电池持续放电,离子交换膜只允许阴离子通过 | |
| C. | 电极a的电极反应式为2NH3-6e-=N2+6H- | |
| D. | 室温下,当有4.48 L NO2被处理时,转移电子为0.8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠保存在煤油中 | |
| B. | 用棕色试剂瓶盛放新制的氯水 | |
| C. | 冷的浓硝酸不能用钢瓶保存 | |
| D. | 向盛放氯化亚铁溶液的试剂瓶中加少量铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,Cu(OH)2在水中的溶度积比其在 Cu(NO3)2溶液中的大 | |
| B. | 一定温度下,将 0.10mol•L-1的氨水加水稀释,溶液中各离子浓度均减小 | |
| C. | H3PO2属于一元弱酸,则H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+OH-═H2PO2-+H2O | |
| D. | 常温下,NaHS溶液中:c(H+)+c(H2S)+c(Na+)=c(S2-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 土豆的淀粉经水解可变成酒 | B. | 油脂经水解可变成葡萄糖 | ||
| C. | 鲜榨橙汁遇到碘水会变蓝 | D. | 馒头越嚼越甜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com