
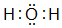 .
.
分析 有A、B、C、D四种短周期元素,其原子序数依次增大,A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2,可推知A为H元素,B为O元素,B、C同主族且可形成CB2和CB3两种化合物,应为SO2和SO3,则C为S元素,故D应为Cl元素.
(1)A2B为H2O,属于共价化合物,分子中氧原子与H原子之间形成1对共用电子对;
(2)SO2通入H2O2溶液中可被氧化为W,则W为H2SO4,b电极发生还原反应,则a电极发生还原反应,Pb失去电子生成PbSO4;
反应的总方程式为PbO2+Pb+2H2SO4=2PbSO4+2H2O,计算消耗H2SO4的物质的量,可得硫酸浓度减小量,根据c=$\frac{1000ρw}{M}$计算原溶液中硫酸物质的量浓度,进而计算一段时间后硫酸的物质的量浓度;
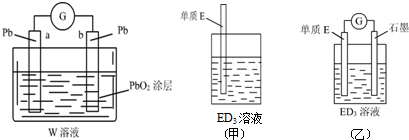
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期,该元素可与D形成ED2和ED3两种化合物,则E为Fe元素,Fe与氯化铁反应生成氯化亚铁;
(4)石墨--铁在氯化铁电解质溶液中形成原电池,Fe为负极,失去电子生成Fe2+,石墨为正极,Fe3+离子在正极获得电子生成Fe2+.
解答 解:有A、B、C、D四种短周期元素,其原子序数依次增大,A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2,可推知A为H元素,B为O元素,B、C同主族且可形成CB2和CB3两种化合物,应为SO2和SO3,则C为S元素,故D应为Cl元素.
(1)A2B为H2O,属于共价化合物,其电子式为: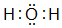 ,
,
故答案为: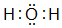 ;
;
(2)SO2通入H2O2溶液中可被氧化为W,则W为H2SO4,b电极发生还原反应,则a电极发生还原反应,Pb失去电子生成PbSO4,负极电极反应式为:Pb-2e-+SO42-=PbSO4,
反应的总方程式为PbO2+Pb+2H2SO4=2PbSO4+2H2O,a极消耗0.05mol Pb,则消耗0.1molH2SO4,已知溶液体积为1L,硫酸浓度减小量为$\frac{0.1mol}{1L}$=0.1mol/L,原H2SO4溶液的质量分数39% (密度1.3g/cm3),则一段时间后溶液中c(H2SO4)=$\frac{1000×1.3×39%}{98}$mol/L-$\frac{0.1mol}{1L}$=5.07mol/L,
故答案为:Pb-2e-+SO42-=PbSO4;5.07;
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期,该元素可与D形成ED2和ED3两种化合物,则E为Fe元素,将Fe浸入到FeCl3中,发生反应为Fe+2Fe3+=3Fe2+,溶液由黄色逐渐变为浅绿色,
故答案为:Fe+2Fe3+=3Fe2+;
(4)石墨--铁在氯化铁电解质溶液中形成原电池,Fe为负极,失去电子生成Fe2+,负极电极反应式为:Fe-2e-=Fe2+,石墨为正极,Fe3+离子在正极获得电子生成Fe2+,正极电极反应式为:2Fe3++2e-=2Fe2+.比较甲、乙两图,说明石墨除形成闭合回路外所起的作用是:使还原反应和氧化反应在电解质溶液中的不同区域内发生,
故答案为:2Fe3++2e-=2Fe2+;使还原反应和氧化反应在电解质溶液中的不同区域内发生.
点评 本题以元素推断为载体,考查电子式、原电池原理的应用、化学计算等,题目难度中等,正确推断元素的种类为解答该题的关键,注意掌握原电池中电极方程式的书写.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | K+、H+、SO42-、OH- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、H+、Cl-、HCO32- | D. | Na+、Cu2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据系统命名法,CH3-CH=CH-CHO的名称是:丁烯醛 | |
| B. | 1 mol HCHO发生银镜反应最多生成2 mol Ag | |
| C. | 对甲基苯甲醛( )使酸性高锰酸钾溶液褪色,说明它含有醛基 )使酸性高锰酸钾溶液褪色,说明它含有醛基 | |
| D. | 能发生银镜反应的有机物不一定是醛类 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸中硫酸物质的量浓度为18.4 mol/L | |
| B. | 配制溶液所需浓硫酸体积为24mL | |
| C. | 配制溶液时仅需的仪器有容量瓶、烧杯、玻璃棒、量筒 | |
| D. | 配制溶液时,量取硫酸注入到烧杯中,加水稀释,冷却后再转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +2 | B. | +3 | C. | +6 | D. | +7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com