
| A. | 钠熔法可定性确定有机物中是否存在氮、氯等元素,将有机样品与金属钠混合熔融,氮、氯将以硝酸钠、氯化钠的形式存在 | |
| B. | 碳原子数小于或等于8的单烯烃,与HBr加成反应的产物只有一种结构,符合条件的单烯烃有6种 | |
| C. | 苯、乙烷、乙烯、乙炔分子中碳碳键的键长分别为a、b、c、d,则b>c>a>d | |
| D. | 等质量的烃完全燃烧,耗氧量最多的是甲烷 |
分析 A.钠具有强的还原性,与N、Cl、Br、S等元素与金属钠混合熔融,得到的是低价态化合物,据此解答;
B.单烯烃与HBr加成反应的产物只有一种结构,说明结构对称;
C.键能越大,键长越短,键能:碳碳三键>碳碳双键>碳碳单键;
D.等质量的烃完全燃烧,烃中氢元素的质量分数越大,耗氧量越高.
解答 解:A.钠具有强的还原性,与N、Cl、Br、S等元素与金属钠混合熔融,得到的是低价态化合物,所以不能得到硝酸钠,故A错误;
B.碳原子数小于或等于8的单烯烃,与HBr加成反应的产物只有一种结构,符合条件的单烯烃有:CH2=CH2、CH3CH=CHCH3、CH3CH2CH=CHCH2CH3、CH3CH2CH2CH=CHCH2CH2CH3、C(CH3)2=C(CH3)2、CH3CH2C(CH3)=C(CH3)CH2CH3、CH3CH(CH3)CH=CHCH(CH3)CH3等,共7种,故B错误;
C.键能越大,键长越短,键能:碳碳三键>碳碳双键>碳碳单键,苯中的化学键键能介于单键与双键之间,所以键长:b>a>c>d,故C错误;
D.等质量的烃完全燃烧,烃中氢元素的质量分数越大,耗氧量越高,所有的烃中H元素的质量分数最大的是甲烷,所以耗氧量最多的是甲烷,故D正确.
故选D.
点评 本题考查了有机物中元素的测定、同分异构体、键能与键长的判断、燃烧规律,题目涉及的知识点较多,题目难度中等,侧重于考查学生的分析能力和对基础知识的综合应用能力.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 向氯水中加食盐不利于氯气的溶解 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往需要使用催化剂 | |
| D. | 高压有利于合成氨的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质的质量分数为ω=$\frac{a}{ρV}$×100% | |
| B. | 溶质的物质的量浓度c=17 V/1 000 a mol•L-1 | |
| C. | 溶液中c(OH-)=V/1 000b mol•L-1 | |
| D. | 上述溶液中再加入V mL水后,所得溶液的质量分数小于0.5ω |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的物质的量浓度 | B. | 混合气体的压强不变 | ||
| C. | 混合气体的密度 | D. | 混合气体的相对分子质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
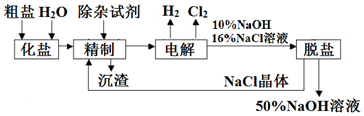
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
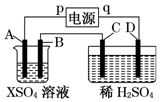 如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:
如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极产生气体的体积(cm3) | 6 | 12 | 20 | 29 | 39] | 49 | 59 | 69 | 79 | 89 |
| 阳极产生气体的体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
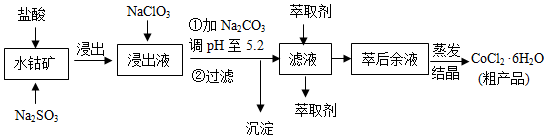
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com