
| 时间(min) 浓度(mol•L-1) | 0 | 5 | 10 | 15 | 25 | 30 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | a | a | b | b |
| CO2 | 0 | 0.21 | a | a | 0.36 | 0.36 |
分析 (1)①分析图表数据结合化学反应速率概念计算v=$\frac{△c}{△t}$,计算平衡浓度结合平衡常数概念是生成物浓度的幂次方乘积除以反应物的幂次方乘积得到;
②反应前后是气体体积不变的反应,图表数据分析可知一氧化氮,二氧化碳浓度都增大,说明改变的条件是缩小体积增大浓度;
③若15min后容器中NO、N2、CO2的浓度之比为4:3;3,时升高温度,达到平衡时容器中NO、N2、CO2的浓度之比为5:3:3,说明平衡逆向进行,逆反应方向是吸热反应,正反应为放热反应;
(2)①生成1mol氮气放出akJ热量,则生成2mol氮气放出2akJ热量,则其热化学反应方程式为2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O(g)△H=-2akJ/mol;
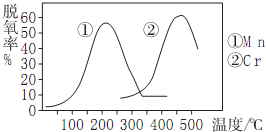
②温度越高,对设备的要求越高,所以如果催化剂在较低温度下能较大程度的脱氮即可;
(3)利用溶度积常数计算溶液中亚硫酸根离子浓度.
解答 解:(1)①v=$\frac{△c}{△t}$=$\frac{1-0.4}{10}$=0.06mol/(L•min);化学平衡三段式列式计算平衡浓度:
C(s)+2NO(g)?N2(g)+CO2(g);
起始量(mol/L) 1 0 0
变化量(mol/L) 0.6 0.3 0.3
平衡量(mol/L) 0.4 0.3 0.3
K=$\frac{0.3×0.3}{0.{4}^{2}}$=0.5625mol/L;
故答案为:0.06mol/(L•min);0.5625;
②只改变某一条件,反应重新达到平衡,图表数据分析可知一氧化氮,氮气,二氧化碳浓度都增大,所以b=c=0.36;
a.加入一定量的活性炭,平衡不移动,各组分的浓度不变,故错误;
b.通入一定量的N2,平衡逆向移动,二氧化氮的浓度减少,故错误;
c.适当缩小容器的体积,故正确;
故答案为:0.36;c;
③若15min后容器中NO、N2、CO2的浓度之比为4:3;3,时升高温度,达到平衡时容器中NO、N2、CO2的浓度之比为5:3:3,说明平衡逆向进行,逆反应方向是吸热反应,正反应为放热反应,故答案为:<;
(2)①生成1mol氮气放出akJ热量,则生成2mol氮气放出2akJ热量,则其热化学反应方程式为2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O(g)△H=-2akJ/mol,故答案为:2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O(g)△H=-2akJ/mol;
②温度越高,对设备的要求越高,所以如果催化剂在较低温度下能较大程度的脱氮即可,所以脱氮时最佳的温度、催化剂应是Mn、200℃左右,故答案为:Mn、200℃左右;
(3)c(SO32- )=$\frac{Ksp(CaS{O}_{3})}{c(C{a}^{2+})}$=$\frac{1.4×1{0}^{-7}}{0.70}$mol/L=2.0×10-7 mol/L,
故答案为:2.0×10-7 mol/L.
点评 本题考查了热化学方程式书写和盖斯定律的计算应用,化学平衡常数和反应速率概念计算应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰石可用于炼铁、制水泥、制玻璃 | |
| B. | 使用苯代替酒精擦拭手机屏幕 | |
| C. | 同位素示踪法、红外光谱法都是科学家经常使用的研究化学反应历程的手段之一 | |
| D. | 针对H7N9禽流感的扩散情况,要加强环境、个人等的消毒预防,可选用含氯消毒剂、酒精、双氧水等作为消毒剂,这种处理方法符合绿色化学的核心 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 向20mL1mol/L的FeBr2溶液中通入0.02molCl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 向漂白粉溶液中通入少量的SO2:SO2+Ca2++2ClO-+H2O═CaSO3↓+2HClO | |
| D. | 单质钠与CuSO4溶液反应:2Na+Cu2+═Cu+2Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:HX>H2Y>ZH3 | B. | 非金属活泼性:Y<X<Z | ||
| C. | 原子半径:X>Y>Z | D. | 原子最外层电子数:Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性 | |
| B. | 常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与分子间的氢键有关 | |
| C. | 乙烯使高锰酸钾褪色和二氧化硫使溴水褪色的原理不相同 | |
| D. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com