
分析 (1)根据N=nNA计算含有水分子数目;
(2)二氧化碳分子中含有2个氧原子,据此计算出含有氧原子数目;根据n=$\frac{N}{{N}_{A}}$计算含有O的物质的量;
(3)根据m=nM计算出氨气质量,根据N=nNA计算出含有H的物质的量;根据V=nVm计算出标况下氨气的体积.
解答 解:(1)2mol H2O含有水分子的数目为:2mol×6.02×1023mol-1=1.204×1024,
故答案为:1.204×1024;
(2)6.02×1023个CO2中含有O的数目为:6.02×1023×2=1.204×1024,含有O的物质的量为:$\frac{1.204×1{0}^{24}}{6.02×1{0}^{23}mo{l}^{-1}}$=2mol,
故答案为:1.204×1024;2;
(3)1.5molNH3的质量为:17g/mol×1.5mol=25.5g;1.5molNH3含有H的物质的量为:1.5mol×3=4.5mol,含有H的数目为4.5NA;标况下1.5mol氨气的体积为:22.4L/mol×1.5mol=33.6L,
故答案为:25.5g;4.5NA;33.6L.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与气体摩尔体积、阿伏伽德罗常数、摩尔质量等之间的关系为解答关键,试题培养了学生的化学计算能力.


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:推断题
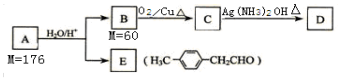
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
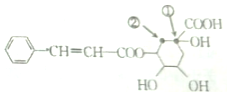
| A. | X分子中含有三种含氧官能团 | |
| B. | 若X中加入溴的四氯化碳溶液或酸性高锰酸钾溶液均褪色,则证明X分子中一定含有碳碳双键 | |
| C. | X能发生加成反应、取代反应、氧化反应和加聚反应 | |
| D. | 将①处碳原子上的-OH转移到②处碳原子上得到的有机物与X互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
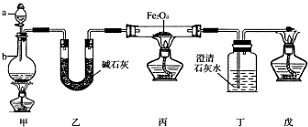
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤所需实验用品有漏斗、烧杯、玻璃棒、铁架台(带铁圈) | |
| B. | 过滤时把漏斗放在铁三脚架上 | |
| C. | 过滤时将玻璃棒斜靠在三层滤纸上 | |
| D. | 过滤时为了加快过滤速度,用玻璃棒搅拌过滤器中的液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH(固体) | B. | 冰醋酸 | C. | HCl | D. | CH3COONa(固体) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③⑥ | C. | ②⑤⑥ | D. | ④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com