
铝是第二金属,是地壳中含量最多的金属,用途广泛。
51.1.将某铝土精矿R(Al2O3、Fe2O3)粉末48.8g加入含1mol NaOH的溶液中,发生的反应为:
Al2O3(s)+2NaOH(aq)+ 2H2O(l)→2NaAl(OH)4(aq)
充分反应后,过滤、洗涤、干燥,得到8.0g固体,则该精矿Al2O3的质量分数为 (精确到0.001)。
往滤液中通入CO2,发生的反应为:2NaAl(OH)4 + CO2→2Al(OH)3↓+ Na2CO3+ H2O
若生成0.5 mol Na2CO3,则生成Al(OH)3 mol。
52.2.有反应Al2O3(s)+ Na2CO3(s)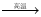 2NaAlO2(s)+ CO2(g)
2NaAlO2(s)+ CO2(g)
2NaAlO2(aq)+ CO2(g) +3H2O→2Al(OH)3↓+ Na2CO3
若以铝土精矿R和Na2CO3为原料,除得到Al2O3外,还得到“赤泥”,其成分为(金属元素均以氧化物形式表示):
Al2O3 | Fe2O3 | Na2O | |
质量分数 | 0.065 | 0.850 | 0.029 |
每1t铝土精矿生产时:
得到的赤泥 t(精确到0.001,下同);
可制得Al2O3得 t;
需要补充购买Na2CO3 kg。
53.3.取a g Al2O3加入溶质的质量分数为b的硫酸溶液中,充分反应后再往溶液加入一定量的(NH4)2SO4,加热、搅拌,冷却后全部溶液正好转化为45.3 g铝铵矾晶体[NH4Al(SO4)2·12H2O,式量:453],则a= ;b= (精确到0.001).
51.1.0.836;0.8;
52.2. 0.193;0.823; 9.569。
53.3.5.1;0.438
【解析】
试题分析:511.由方程式:Al2O3(s)+2NaOH(aq)+ 2H2O(l)→2NaAl(OH)4(aq),固体质量减少量即为Al2O3的质量,Al2O3的质量分数为(48.8g-8.0g)/48.8g=0.836。
由方程式:
Al2O3(s)+2NaOH(aq)+ 2H2O(l)→2NaAl(OH)4(aq)
102g 2mol
40.8g n(NaOH)
解得n(NaOH)=0.8mol
可知剩余NaOH的物质的量为1mol-0.8mol=0.2mol
2NaOH + CO2= Na2CO3+ H2O
2 1
o.2mol n(CO2)
解得 n(CO2)=0.1mol
2NaAl(OH)4 + CO2=2Al(OH)3↓+ Na2CO3+ H2O
1 2
0.4mol n[Al(OH)3]
解得 n[Al(OH)3]=0.8mol
52、2.由表中数据可得,每1t铝土精矿生产时:得到的赤泥的质量为1t×(1-0.836)/0.850=0.193t。
可制得Al2O3的质量为1t×0.836-0.193t×0.065=0.823t;
需要补充购买Na2CO3的质量为0.193×103kg×0.029÷62×106=9.569kg。
53、3.利用a g Al2O3与45.3 g铝铵矾晶体中的Al元素质量相等,则a×54/102=45.3×27/453解得a=5.1;b= (精确到0.001).
设(NH4)2SO4的质量为m,则:m×36/132=45.3×18/453,解得m=6.6g
则硫酸溶液中溶质的质量分数b=(2×45.3/453-6.6/132)×98/(45.3-5.1-6.6)=0.438
考点:了解铝及其化合物的性质。了解金属的冶炼方法。


科目:高中化学 来源:2014-2015北京市丰台区高一上学期期末考试化学试卷(解析版) 题型:选择题
在“空气质量日报”中,不被列入首要污染物的是
A.二氧化硫 B.氮氧化物 C.可吸入颗粒物 D.二氧化碳
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三上学期期中考试化学试卷(解析版) 题型:填空题
硫元素有多种化合价,可形成多种化合物。
(1)常温下用1 molL-1 100 mL NaOH溶液恰好完全吸收0.1 mol SO2气体,此反应的离子方程式为 ;该溶液pH<7的原因是 (结合方程式回答)。以石墨作电极,电解该物质的饱和溶液时,只有一个电极产生气体,写出阳极的电极反应式 。
(2)请按照浓度由大到小的顺序排列0.1mol/LNa2SO3溶液中的离子 。Na2SO3溶液放置于空气中一段时间后,溶液的pH (填“增大”“减小”或“不变”)。
(3)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。

实验①可说明 (填字母)
A.该Na2S2O3溶液中水电离的c(OH—)=10—8mol/L
B.H2S2O3是一种弱酸
C.Na2S2O3是一种弱电解质
D.Na2S2O3水解方程式为S2O32—+2H2O H2S2O3+2OH—
H2S2O3+2OH—
写出实验②发生反应的离子方程式 。
(4)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40 mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
(5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O) 。试回答:
①此滴定实验是否需要指示剂 (填“是”或“否”),KMnO4溶液置于 (填“酸式”或“碱式”)滴定管中。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果会 (填“偏高”“偏低”或“不变”)。
③产品中Na2S2O3·5H2O的质量分数为 。(Na2S2O3·5H2O式量:248)(保留小数点后两位数)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三上学期期中考试化学试卷(解析版) 题型:选择题
两种元素X、Y,其原子核外电子层数分别为a、b,最外层电子数分别为m、n。下列说法错误的是
A.若8>m>3,则X必定为主族元素
B.若a<b<m=n=4,则晶体类型相同时,其单质熔点:Y>X
C.若Y的气态氢化物化学式为YHn,且b<4,则该氢化物为非极性分子
D.若a=b=3,8>m>n>b,则元素非金属性:X>Y
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.有H、D、T与16O、17O、18O构成的过氧化氢分子的相对分子质量有36个
B.H2、D2、T2互为同素异形体
C.H2、D2、T2在相同条件下的密度比为1:2:3
D.氕、氘发生聚变成其他元素,属于化学变化
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末教学质量检测化学试卷(解析版) 题型:填空题
磷是重要的非金属元素。
28.1.有关的叙述正确的是 (选填编号)。
a.易溶于CS2 b.易自燃 c.分子中有4个P-P键
P4在过量的热NaOH溶液中会生成PH3气体和NaH2PO2(次磷酸钠),写出该反应的化学方程式 。
由该反应可推知H3PO2为 元酸。用NaH2PO2来验证次磷酸是弱酸,还需要的物质是 。
29.2.NaH2PO2可在酸性条件下与Ni2+作用进行“化学镀镍”(如在木材表面生成一层Ni-P合金),反应中磷元素化合价发生的变化是 (选填编号)。
a.升高 b.降低 c.既升高又降低
30.3.25℃时,HF的Ki = 3.6×10 – 4 ;H3PO4的 Ki1= 7.5×10 -3,Ki2= 6.2×10 -8,Ki3= 2.2×10 -13。
则以下表述错误的是 (选填编号)。
a.0.1mol/L的H3PO4溶液,c(H+)>0.1mol/L
b.NaF和H3PO4反应生成NaH2PO4
c.0.1mol/L的溶液,pH由大到小的顺序是:Na3PO4>Na2HPO4>NaF>NaH2PO4
31.4.Ag3PO4是难溶于水的黄色固体,试用平衡移动的原理解释其溶于稀硝酸的原因 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末教学质量检测化学试卷(解析版) 题型:选择题
某稀土元素R的精矿样品中,R的氧化物的质量分数为0.8515。20.2g该样品与100 mL 1mol/L稀硫酸恰好完全反应(杂质不反应),生成ROSO4和H2O,则R的相对原子质量约为
A.78 B.140 C.156 D.172
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:填空题
(12分)香豆素是一种天然香料,存在于黑香豆、兰花等植物中。工业上常用水杨醛与乙酸酐在催化剂存在下加热反应制得:

以下是由甲苯为原料生产香豆素的一种合成路线(部分反应条件及副产物已略去)
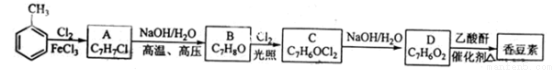
已知以下信息:
①A中有五种不同化学环境的氢;
②B可与FeCl3溶液发生显色反应;
③同一个碳原子上连有两个羟基通常不稳定,易脱水形成羰基。
请回答下列问题:
(1)A的化学名称为__________;
(2)香豆素的分子式为_______;由甲苯生成A的反应类型为___________;
(3)B的同分异构体中含有苯环的还有_____种,其中在核磁共振氢谱中只出现四组峰的有_____种;
(4)由B生成C的化学反应方程式为___________;
(5)D的同分异构体中含有苯环的还有______种,其中:既能发生银境反应,又能发生水解反应的是________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考化学试卷(解析版) 题型:选择题
赤铜矿的成份是Cu2O,辉铜矿的成份是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O+Cu2S 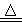 6Cu+SO2↑,对于该反应,下列说法正确的是
6Cu+SO2↑,对于该反应,下列说法正确的是
A.该反应的氧化剂只有Cu2O
B.Cu既是氧化产物又是还原产物
C.每生成1 mol Cu,还原剂转移给氧化剂的电子为2 mol
D.该反应中氧化产物与还原产物的质量比为1∶6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com