
| A. | 油脂在空气中完全燃烧转化为水和二氧化碳 | |
| B. | 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 | |
| C. | 在水溶液里,乙酸分子中的-CH3可以电离出H+ | |
| D. | 医学上了利用银镜反应来检验患者尿液中葡萄糖含量是否偏高 |
分析 A.油脂含有碳、氢、氧三种元素,完全燃烧生成二氧化碳和水;
B.分子式相同结构不同的物质属于同分异构体;
C.乙酸中电离出氢离子的是羧基;
D.葡萄糖中的醛基可发生银镜反应.
解答 解:A.油脂属于烃类含氧衍生物,且只含碳、氢、氧三种元素,所以完全燃烧时生成二氧化碳和水,故A正确;
B.蔗糖和麦芽糖的分子式相同但结构不同,所以属于同分异构体,故B正确;
C.乙酸中电离出氢离子的是羧基而不是甲基,故C错误;
D.葡萄糖中的醛基可被银氨溶液氧化,可用来检验葡萄糖,故D正确;
故选C.
点评 本题考查了有机物的结构和性质,涉及同分异构体的判断、物质的检验等知识点,难度不大,注意基础知识的积累.


科目:高中化学 来源: 题型:选择题
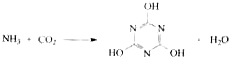 下列有关三聚氰胺的说法正确的是( )
下列有关三聚氰胺的说法正确的是( )| A. | 分子式为C3H6N3O3 | B. | 分子中既含极性键,又含非极性键 | ||
| C. | 属于共价化合物 | D. | 生成该物质的上述反应为中和反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{6}^{12}$C和${\;}_{6}^{14}$C互为同位素 | B. | 02和03互为同素异形体 | ||
| C. | 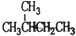 和 和 互为同分异构体 互为同分异构体 | D. | 干冰和冰为不同种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
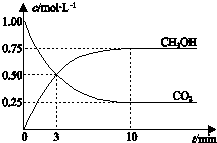
| A. | 升高温度能使$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$ 增大 | |
| B. | 反应达到平衡状态时,CO2的平衡转化率为75% | |
| C. | 3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 | |
| D. | 从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
已知下列两个气态物质之间的反应:
C2H2(g)+H2(g)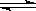 C2H4(g)①
C2H4(g)①
2CH4(g)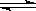 C2H4(g)+2H2(g)②
C2H4(g)+2H2(g)②
已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:
(Q1、Q2、Q3均为正值)
C(s)+2H2(g)=CH4(g)ΔH=-Q1
2C(s)+H2(g)=C2H2(g)ΔH=-Q2
2C(s)+2H2(g)=C2H4(g)ΔH=-Q3Q值大小比较正确的是( )
A. Q1>Q3>Q2 B. Q1>Q2>Q3 C. Q2>Q1>Q3 D. Q3>Q1>Q2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考一化学试卷(解析版) 题型:填空题
在一定温度下,向一个容积不变的容器中,通入2mol SO2和2mol O2及固体催化剂,使之反应。2SO2(g)+O2(g) 2SO3(g);ΔH=-196 KJ/mol。平衡时容器内气体压强为起始时的90%。此时
2SO3(g);ΔH=-196 KJ/mol。平衡时容器内气体压强为起始时的90%。此时
(1)加入2mol SO2和2mol O2发生反应,达到平衡时,放出的热量为 ;
(2)保持同一反应温度,在相同的容器中,将起始物质的量改为amol  SO2、bmol O2、cmol SO3(g),欲使平衡时SO3的体积分数为2/9,
SO2、bmol O2、cmol SO3(g),欲使平衡时SO3的体积分数为2/9,
①达到平衡时,⑴与⑵放出的热量 (填序号)。
A.一定相等 B.前者一定小 C.前者大于或等于后者
②a、b、c必须满足的关系是 、 (一个用a、c表示,另一个用 b、c表示),
b、c表示),
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 水解反应 | 平衡常数(K) |
| Fe3++3H2O?Fe(OH)3+3H+ | 7.9×10-4 |
| Fe2++2H2O?Fe(OH)2+2H+ | 3.2×10-10 |
| Cu2++2H2O?Cu(OH)2+2H+ | 3.2×10-7 |
| 实验内容 | 实验现象 |
| 甲同学的实验方案 | 溶液逐渐变成蓝绿色,pH略有上升 |
| 乙同学的实验方案 | 无明显现象,pH没有明显变化. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com