
| A. | 在密闭容器中加入3mol H2和1molN2,充分反应后可得到NH3分子数为2NA | |
| B. | 0.1mol/L Na2SO4溶液中含有Na+为0.2NA | |
| C. | 一定条件下,23 g Na与O2反应生成Na2O2时失去的电子数为NA | |
| D. | 标准状况下,22.4L SO3中含有的氯原子数为3NA |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
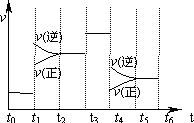
| A. | t2~t3和t3~t4时间段氨气的体积分数相等 | |
| B. | 氨气的体积分数最高的一段时间为t5~t6 | |
| C. | t4时刻改变的条件是降低温度 | |
| D. | t4~t5时间段平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 工业上通常用电解Na、Mg、Al对应的氯化物制取三种金属单质 | |
| C. | 燃料电池中燃料都是在负极发生氧化反应 | |
| D. | Fe3O4俗称铁红,常作红色油漆和涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol | B. | 0.03mol | C. | 0.05mol | D. | 0.07mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HSO3-在溶液中发生水解:HSO3-+H2O?SO32-+H3O+ | |
| B. | 向Mg(OH)2浊液中滴加FeCl3溶液生成红褐色沉淀:3OH-+Fe3+=Fe(OH)3↓ | |
| C. | 碳酸氢钠溶液显碱性:HCO3-+H2O?H2CO3+OH- | |
| D. | 惰性电极电解MgCl2溶液:Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$OH-+Cl2↑+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 现有CO CO2 O3三种气体,它们分别都含有1摩尔O,则三种气体的物质的量之比3:2:1 | |
| B. | 5.6gCO和22.4L CO2中含有碳原子数一定相等 | |
| C. | 标况下,11.2升X气体分子质量为16g,则X气体的摩尔质量为32 | |
| D. | ngCl2中有m个Cl原子,则阿伏伽德罗常数NA的数值可以表示为 35.5m/n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 广泛PH试纸可测定某溶液的PH值为13 | |
| B. | 将PH试纸湿润后,测得的PH值一定有误差 | |
| C. | 用PH试纸蘸取溶液,过半分钟与标准比色卡对比 | |
| D. | 精密pH试纸,测得的PH值一定不能为7.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
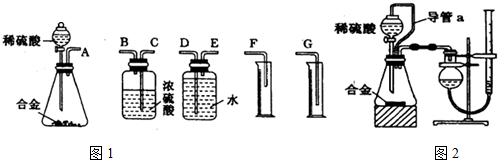
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com