
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 2Fe+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3 | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | CaO+CO2═CaCO3 | D. | 2H2O+2Na═2NaOH+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol | B. | 0.2 mol | C. | 0.3mol | D. | 0.4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)亚磷酸(H3PO3)是二元酸,与足量NaOH溶液反应,生成Na2HPO3,电解Na2HPO3溶液可得到亚磷酸,装置示意图如下:
(1)亚磷酸(H3PO3)是二元酸,与足量NaOH溶液反应,生成Na2HPO3,电解Na2HPO3溶液可得到亚磷酸,装置示意图如下:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | “白毛”的主要咸分是氧化铝 | |
| B. | 在长出“白毛”过程中,铝片的温度会升高 | |
| C. | 若用硝酸汞溶液代替汞就无法看到类似的现象 | |
| D. | 此过程中涉及到的化学变化与原电池的原理有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 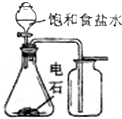 实验室制备并收集乙炔 | B. | 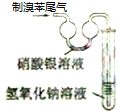 证明溴苯中含溴元素 | ||
| C. | 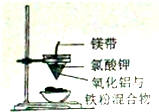 铝热反应 | D. | 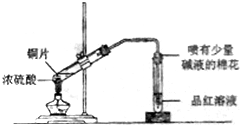 检测铜与浓硫酸反应的气体产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com