
| ||
| ||
| V |
| Vm |
| n |
| V |
| bL |
| 22.4L/mol |
| 1000b |
| 11.2V |
| 1 |
| 2 |
| cV |
| 125 |
| cV |
| 125 |
| 17Vc |
| 1000 |
| 17Vc |
| 1000 |
| mg |
| 56g/mol |
| 1 |
| 2 |
| 10m |
| 7 |
| mg |
| 27g/mol |
| 1 |
| 2 |
| 17m |
| 9 |


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市朝阳区高三上学期期末考试化学试卷(解析版) 题型:填空题
用含有Al2O3及少量Fe2O3和SiO2的铝土矿制备净水剂——液体聚合硫酸铝铁,工艺流程如下(部分操作和条件略):
I.向铝土矿中加入过量H2SO4后,加热、搅拌、过滤。
II.向滤液中加入一定量的FeSO4·7H2O和双氧水。
III.向溶液中加入Ca(OH)2固体,调节溶液的pH约为1,过滤。
IV.加入稳定剂,加热,得到产品。
(1)Fe2O3与H2SO4反应的离子方程式是___________。
(2)步骤I中过滤得到的滤渣成分是________(填化学式)。
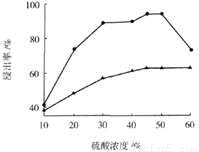
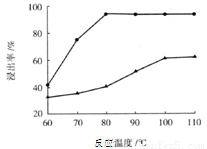
(3)步骤I 中H2SO4的浓度与反应温度会影响铁与铝的浸出率。根据下图分析,步骤I 中H2SO4浓度的适宜范围是__________,反应的适宜温度是_________。

(4)步骤II中增大n(Fe3+)的离子方程式是_________。
(5)步骤III得到碱式硫酸铝铁[AlFe(OH)n(SO4)m]的溶液,则步骤II中应增大n(Fe3+)到
n(Al3+)﹕n(Fe3+)= 。
(6)研究表明,液体聚合硫酸铝铁的纯度越高,净水效果越好。已知:
一些物质在20℃时的溶解度
|
物质 |
Ca(OH)2 |
CaSO4 |
Na2SO4 |
|
溶解度/g |
0.153 |
0.258 |
19.5 |
结合表中数据,解释步骤III中使用Ca(OH)2而不用NaOH的原因__________。
(7)铝土矿也可用于冶炼金属Al。以金属Al作阳极,稀硫酸作电解液,通过电解会使金属Al的表面生成致密坚硬的氧化膜,其电极反应式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
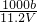
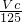
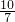 m<p<
m<p<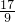 m
m查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com