
下列变化是在克服分子间作用力的情况下进行的是( )
A.碘的升华 B.氨的液化
C.铝的熔化 D.食盐的溶解
科目:高中化学 来源: 题型:
温度为T ℃时,在体积为10 L的真空容器中通入1.00 mol氢气和1.00 mol碘蒸气,20 min后,反应达到平衡,此时测得碘蒸气的浓度为0.020 mol·L-1。涉及的反应可以用下面的两个化学方程式表示:
①H2(g)+I2(g)2HI(g)
②2H2(g)+2I2(g)4HI(g)
下列说法正确的是( )
A.反应速率用HI表示时,v(HI)=0.008 mol·L-1·min-1
B.两个化学方程式的意义相同,但其平衡常数表达式不同,不过计算所得数值相同
C.氢气在两个反应方程式中的转化率不同
D.第二个反应中,增大压强平衡向生成HI的方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素M的逐级电离能(kJ·mol-1)分别为580,1 820,2 750,11 600。该元素氧化物的化学式最可能是( )
A.MO B.MO2
C.MO3 D.M2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
NH3与BF3可以通过配位键形成NH3·BF3。
(1)配位键的形成条件是__________________________________________________
__________________________________________。
(2)NH3·BF3中____________原子提供孤对电子,
____________原子提供空轨道。
查看答案和解析>>
科目:高中化学 来源: 题型:
三氯化氮(NCl3)在常温下是一种淡黄色液体,其分子结构呈三角锥形。则下列说法正确的是( )
A.分子中N—Cl键是非极性键
B.分子中不存在孤对电子
C.它的沸点比PCl3的低
D.因N—Cl键能大,所以NCl3沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
答案 COS为直线形结构;CO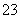 为平面正三角形结构;PCl3为三角锥形结构。
为平面正三角形结构;PCl3为三角锥形结构。
解析 COS与CO2互为等电子体,其结构与CO2相似,所以其为直线形结构;CO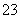 与SO3互为等电子体,结构相似,所以CO
与SO3互为等电子体,结构相似,所以CO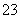 为平面正三角形结构;PCl3与NF3互为等电子体,结构相似,所以PCl3为三角锥形结构。
为平面正三角形结构;PCl3与NF3互为等电子体,结构相似,所以PCl3为三角锥形结构。
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质性质的变化规律,与共价键键能大小有关的是( )
A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.H2O熔沸点高于H2S,HF熔沸点高于HCl
D.NaF、NaCl、NaBr、NaI的熔点依次降低
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)原子的最外层有2个电子的元素一定是ⅡA族元素( )
(2)元素所在的主族序数与最外层电子数之比为1的元素都是金属元素( )
(3)原子及离子的核外电子层数等于该元素所在的周期数( )
(4)原子最外层电子数大于3(小于8)的元素一定是非金属元素( )
(5)某元素的离子的最外层与次外层电子数相同,该元素一定位于第三周期( )
(6)最外层电子数等于或大于3(小于8)的一定是主族元素( )
(7)最外层有1个或2个电子,则可能是ⅠA、ⅡA族元素,也可能是副族、Ⅷ族元素或0族元素氦( )
(8)最外层电子数比次外层电子数多的元素一定位于第二周期( )
(9)某元素阴离子最外层电子数与次外层相同,该元素位于第三周期;若为阳离子,则位于第四周期( )
(10)电子层结构相同的离子,若电性相同,则位于同周期,若电性不同,则阳离子位于阴离子的下一周期——“阴上阳下”规律( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com