
| A. | 碳酸钠(固体) | B. | 水 | C. | 硫酸钾溶液 | D. | 浓硝酸 |
科目:高中化学 来源: 题型:解答题
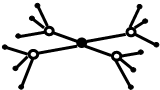 周期表前四周期的元素X、Y、Z、T、W,原子序数依次增大.X的核外电子总数与其周期数相同,Y基态原子的p电子数比s电子数少1个,Z基态原子的价电子层中有2个未成对电子,T与Z同主族,W基态原子的M层全充满,N层只有一个电子.回答下列问题:
周期表前四周期的元素X、Y、Z、T、W,原子序数依次增大.X的核外电子总数与其周期数相同,Y基态原子的p电子数比s电子数少1个,Z基态原子的价电子层中有2个未成对电子,T与Z同主族,W基态原子的M层全充满,N层只有一个电子.回答下列问题: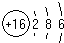 ,W基态原子的电子排布式为[Ar]3d104s1.
,W基态原子的电子排布式为[Ar]3d104s1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
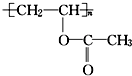 ,下列关于该有机物叙述不正确的是( )
,下列关于该有机物叙述不正确的是( )| A. | 1 mol 该有机物与 NaOH 溶液完全反应时,消耗 NaOH 1 mol | |
| B. | 该有机物水解所得产物能发生取代反应 | |
| C. | 该有机物可通过加聚反应生成 | |
| D. | 该有机物分子中含有双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、NH4+、SO42-、NO3- | B. | OH-、K+、NH4+、Cl- | ||
| C. | Fe3+、Cl-、Na+、OH- | D. | Fe2+、H+、SO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ca2+、HCO3-、Cl- | B. | Na+、K+、Cl-、SO42- | ||
| C. | NH4+、K+、Cl-、SO32- | D. | K+、Cl-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应是放热反应,升高温度,正反应速率增大 | |
| B. | 往容器中通入稀有气体He,由于压强增大,所以反应速率增大 | |
| C. | 往容器中加入少量A,反应速率增大 | |
| D. | 当容器内的压强不再变化,可以判断反应已经达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
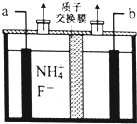 (1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体.已知:
(1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体.已知:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com