
分析 (1)酸性氧化物是能和碱反应生成盐和水的氧化物;碱性氧化物是能和酸反应生成盐和水的氧化物;两性氧化物是既能和酸反应生成盐和水,又能和碱反应生成盐和水的氧化物;
(2)Al2O3、Fe2O3分别为两性氧化物和碱性氧化物,而SiO2是酸性氧化物;Al2O3、Fe2O3与盐酸反应后所得的滤液的成分为AlCl3和FeCl3,加入NaOH溶液至过量,据此分析反应和滤渣;
(3)Al2O3是两性氧化物,SiO2是酸性氧化物,均能与氢氧化钠溶液反应;
(4)第(3)题反应所得的混合物过滤,滤液中含AlO2-和SiO32-,通入二氧化碳,均与二氧化碳反应.
解答 解:(1)Al2O3既能和酸反应生成盐和水,又能和碱反应生成盐和水的氧化物,故是两性氧化物;Fe2O3能和酸反应生成盐和水的氧化物,故是碱性氧化物,
故答案为:两性;碱性;
(2)Al2O3、Fe2O3分别为两性氧化物和碱性氧化物,能溶于盐酸,而SiO2是酸性氧化物,与盐酸不反应,故所得的滤渣为SiO2;Al2O3、Fe2O3与盐酸反应后所得的滤液的成分为AlCl3和FeCl3,加入NaOH溶液至过量,将Al3+转化为AlO2-,将Fe3+转化为Fe(OH)3沉淀,故所得滤渣的主要成分为Fe(OH)3,
故答案为:SiO2;Fe(OH)3;
(3)Al2O3是两性氧化物,SiO2是酸性氧化物,均能与氢氧化钠溶液反应:Al2O3+2OH-+3H2O=2[Al(OH)4]-,SiO2+2OH-=SiO32-+H2O,
故答案为:Al2O3+2OH-+3H2O=2[Al(OH)4]-;
(4)第(3)题反应所得的混合物过滤,滤液中含AlO2-和SiO32-,通入二氧化碳后发生反应为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,SiO32-+2CO2+2H2O=
H2SiO3↓+2HCO3-,故所得到的沉淀为Al(OH)3、H2SiO3,故答案为:Al(OH)3、H2SiO3.
点评 本题考查了酸性氧化物、碱性氧化物和两性氧化物的概念和性质,应注意概念的把握,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
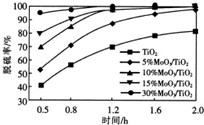 用TiO2负载MoO3催化剂使有机物R催化脱硫,负载MoO3的量对反应脱硫率的影响如图.下列说法正确的是( )
用TiO2负载MoO3催化剂使有机物R催化脱硫,负载MoO3的量对反应脱硫率的影响如图.下列说法正确的是( )| A. | 负载MoO3的量越大,平衡常数越大 | |
| B. | 当反应时间小于0.5h,脱硫率为0 | |
| C. | 1.6h负载MoO3的量为10%和15%的脱硫率相等 | |
| D. | 0.5~1.2h时,负载MoO3的量越大,脱硫速率越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某可逆反应达平衡状态时反应物和生成物共存 | |
| B. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2+O2与2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O互为可逆反应 | |
| C. | 对于可逆反应,加入催化剂可使正逆反应速率均增大 | |
| D. | 提高可逆反应的限度可增加产量,从而提高经济效益 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置如图.下列说法正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置如图.下列说法正确的是( )| A. | 五种元素中,原子半径最大的是W | |
| B. | Y的简单阴离子比W的简单阴离子还原性强 | |
| C. | Y与Z形成的化合物都可以和盐酸反应 | |
| D. | Q形成的含氧酸一定比W形成的含氧酸强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

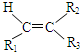 $→_{ⅱZn/H_{2}O}^{ⅰO_{3}}$ R1CHO+
$→_{ⅱZn/H_{2}O}^{ⅰO_{3}}$ R1CHO+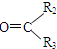
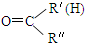 $\stackrel{一定条件下}{→}$ R-
$\stackrel{一定条件下}{→}$ R-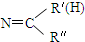 +H2O
+H2O .
.

 .
.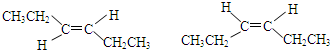 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
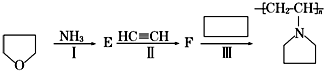
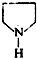 ,F
,F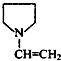
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①②③⑤ | C. | ①③⑤ | D. | ①③⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com