
【题目】下列关于元素周期表的说法中正确的是
A.同一主族元素的原子序数的差不可能为10
B.同周期第ⅡA族与第ⅢA族元素的原子序数差值一定是1
C.催化剂一般在金属与非金属的分界线处寻找
D.过渡元素全部是金属元素
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某主族元素的离子X2+有6个电子层,最外层有2个电子,当把XO2溶于浓盐酸时,有黄色气体产生,则下列说法不正确的是
A. X2+具有还原性 B. X的+2价化合物比+4价化合物稳定
C. XO2具有强氧化性 D. 该元素是第ⅡA族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学健断裂时吸收的能量与化学健形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是
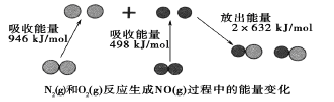
A. 1molN2(g)和1molO2(g)反应放出的能量为180kJ
B. 1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量
C. 在1L的容器中发生反应.10min内N2减少了1mol,因此10min内的平均反应速率为v(NO)=0.1mol/(L·min)
D. NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铁、铜等在工农业生产中有着广泛的应用。回答下列问题:
(1)铜元素位于元素周期表中的___区,其基态原子的价电子排布图为_________。
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是_______。
②在[Cu(NH3)4]SO4中,配离子所含有的化学键为________,提供孤电子对的成键原子是_______。
③ 除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为_______。
④NF3与NH3的空间构型相同,中心原子的轨道杂化类型均为_____。但NF3不易与Cu2+形成化学键,其原因是____________。
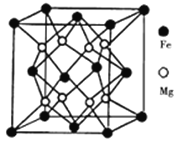
(3)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。则铁镁合金的化学式为________,若该晶胞的参数为dnm,则该合金的密度为____ g/cm3(不必化简,用NA表示阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):

已知:(a) 
(b) ![]() (苯胺易被氧化)
(苯胺易被氧化)
请回答下列问题:
(1)D的结构简式为____;烃A的分子式为________。
(2)反应②的反应类型是__________。
(3)①下列对该抗结肠炎药物有效成分可能具有的性质推测正确的是_______;
A.水溶性比苯酚好 B.能发生消去反应,也能发生聚合反应
C.既有酸性又有碱性 D.1mol该物质最多可与4molH2发生反应
②E与足量NaOH溶液反应的化学方程式为_______________。
(4)符合下列条件的抗结肠炎药物有效成分的同分异构体有____种。
A.遇FeCl3溶液发生显色反应
B.分子中甲基与苯环直接相连
C.苯环上共有三个取代基
(5)已知:苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位,据此按先后顺序写出以A为原料合成邻氨基苯甲酸 (![]() )合成路线中两种中间产物的结构简式(部分反应条件已略去)。A→________→_________→
)合成路线中两种中间产物的结构简式(部分反应条件已略去)。A→________→_________→![]() ____________
____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习物质结构和性质的重要工具,下图是元素周期表的一部分,表中所列字母A、D、F、G、Q、M、R、N、T分别代表某种化学元素。请依据这9种元素回答下列问题。
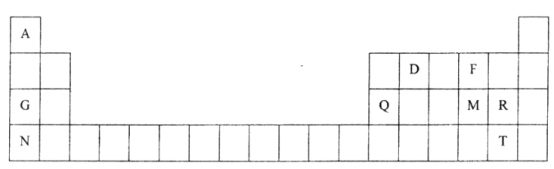
(1)以上9种元素中金属性最强的元素是_______(填元素符号)。
(2)元素的非金属性:M______R(填“>”或“<”)。
(3)R的最高价氧化物对应水化物的化学式是_____________。
(4)F、G两元素形成的淡黄色固体物质的电子式为_____________。
(5)表中M、R、N元素可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是_____________(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列现象或事实的解释正确的是
选项 | 现象或事实 | 解释 |
A | 蒸发NaAlO2溶液可以获得固体NaAlO2 | NaAlO2在水中不会水解 |
B | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl反应生成氨气会降低肥效 |
C | 漂白粉在空气中久置变质 | 漂白粉中的ClO-可以水解成HClO |
D | FeCl3溶液可用于水处理 | FeCl3中Fe3+具有氧化性可杀菌消毒 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用1L1molL﹣1NaOH溶液吸收0.6molCO2 , 所得溶液中Na2CO3和NaHCO3的物质的量之比约为( )
A.2:3
B.1:2
C.2:1
D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
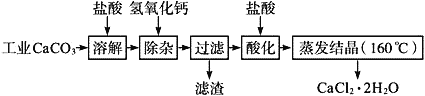
【题目】医用氯化钙可用于生产补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2、2H2O的质量分数为97.0%~103.0%)的主要流程如下:
已知:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Al(OH)3 | |
开始沉淀时的pH | 2.3 | 4.0 | 开始溶解时的pH | 7.8 |
完全沉淀时的pH | 3.7 | 5.2 | 完全溶解时的pH | 10.8 |
(1)CaCO3与盐酸反应的离子方程式___________。
(2)“除杂”操作是加入氢氧化钙,调节溶液的pH范围为________,目的是除去溶液中的少量Al3+、Fe2+。
(3)过滤时需用的比玻璃器有__________。
(4)“酸化”操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①防止氢氧化钙吸收空气中的二氧化碳;②防止Ca2+在蒸发时水解;③_______。
(5)蒸发结晶要保持在160℃的原因是__________。
(6)测定样品中Cl-含量的方法是:称取0.750 0 gCaCl2·2H2O样品,溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中;用0.050 00 mol/L AgNO3溶液滴定至终点(用K2Cr2O2),消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需用溶液润洗的仪器有________。
②计算上述样品中CaCl2·2H2O的质量分数为_______。(保留四位有效数字)
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有________;__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com