
| A. | 次氯酸的结构式:H-Cl-O | B. | CO2的比例模型  | ||
| C. | 甲基的电子式: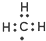 | D. | 硬脂酸的化学式:C17H33COOH |
分析 A、HClO为共价化合物,分子中存在1个O-H键和1个Cl-O键,中心原子为O;
B、比例模型表示原子的相对大小及原子连接顺序、空间结构;
C、甲基不显电性,既没失电子也没得电子;
D、硬脂酸俗称十八酸,是饱和的高级脂肪酸.
解答 解:A、HClO为共价化合物,分子中存在1个O-H键和1个Cl-O键,中心原子为O,结构式为:H-O-Cl,故A错误;
B、二氧化碳的分子式为CO2,由模型可知小球为碳原子,2个大球为氧原子,氧原子半径大,实际碳原子半径大于氧原子半径,其正确的比例模型为: ,故B错误;
,故B错误;
C、甲基不显电性,既没失电子也没得电子,故甲基的电子式为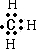 ,故C正确;
,故C正确;
D、硬脂酸俗称十八酸,是饱和的高级脂肪酸,故化学式为C17H35COOH,故D错误.
故选C.
点评 本题考查了常见的化学用语的书写,难度不大,应注意比例模型中原子间的连接顺序以及原子之间的相对大小,并注意和球棍模型的区别.


科目:高中化学 来源: 题型:解答题
 臭氧是一种强氧化剂可与碘化钾水溶液发生反应生成氧气和单质碘.向反应后的溶液中滴入酚酞,溶液变为红色.
臭氧是一种强氧化剂可与碘化钾水溶液发生反应生成氧气和单质碘.向反应后的溶液中滴入酚酞,溶液变为红色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 直径介于1nm-100nm之间的微粒称为胶体 | |
| C. | 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 | |
| D. | 溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题




查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,K是黑色固体,D和F反应可用于工业上生产漂白液,H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和反应条件未列出)
在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,K是黑色固体,D和F反应可用于工业上生产漂白液,H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和反应条件未列出)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有10NA个电子转移时,放出1300kJ的能量 | |
| B. | 有1NA个水分子生成且为液体时,吸收1300kJ的能量 | |
| C. | 有2NA个碳氧共用电子对生成时,放出1300kJ的能量 | |
| D. | 有8NA个碳氧共用电子对生成时,吸收1300kJ的能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com