
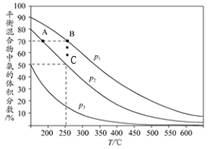
 在一定条件下,反应A2+B2?2AB;△H=QkJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线.下列有关说法正确的是( )
在一定条件下,反应A2+B2?2AB;△H=QkJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线.下列有关说法正确的是( )| A. | △H>0 | B. | AB一定是气体物质 | ||
| C. | 反应温度a低于b | D. | A2、B2中最少有一种是气态物质 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
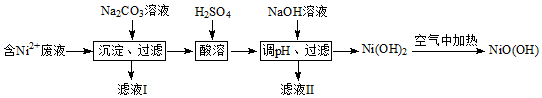
 实验室用如图所示仪器和药品做CO2和Na2O2反应制O2的实验,试填写下列空白.
实验室用如图所示仪器和药品做CO2和Na2O2反应制O2的实验,试填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
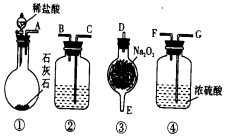
 氨在国民经济中占有重要地位.
氨在国民经济中占有重要地位.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何化学反应都能设计成原电池 | |
| B. | 手机上用的锂离子电池属于一次电池 | |
| C. | 原电池中的阳离子向负极移动 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,5.6gFe与足量水蒸气反应,转移的电子数为0.3NA | |
| B. | 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA | |
| C. | 100g质量分数为17%的H2O2的水溶液中,极性共价键的数目为NA | |
| D. | 室温下向1L pH=1的醋酸溶液中加水稀释,所得溶液中的H+数目大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
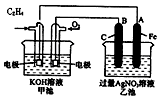 如图是一个化学过程的示意图,请根据该示意图完成下列题目:
如图是一个化学过程的示意图,请根据该示意图完成下列题目:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com