
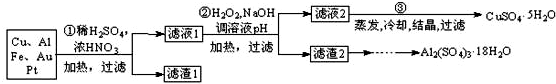
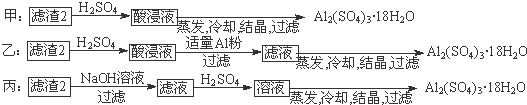
| ||
| ||
| 100mL |
| 20mL |
| cmol/L×b×10-3L×250g/mol×5 |
| ag |
| cmol/L×b×10-3L×250g/mol×5 |
| ag |


科目:高中化学 来源: 题型:
| A、生成物的总能量总是低于反应物的总能量 |
| B、应用盖斯定律,可计算某些难以直接测量的反应热 |
| C、化学反应中的能量变化都表现为热量变化 |
| D、需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 |
| ①取少量原溶液,加入稀盐酸, | 产生无色气体,该气体能使澄清的石灰水变浑浊 |
| ②取少量原溶液加热浓缩,加入Cu片和一定浓度的H2SO4 | 有无色气体产生,该气体遇空气变成红棕色 |
| ③取少量原溶液,加入BaCl2溶液 | 有白色沉淀生成 |
| ④取③中上层清液,先加入稀硝酸,再加入AgNO3溶液 | 有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
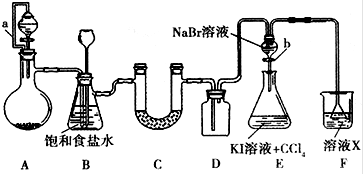
| ① | ② | ③ | ④ | |
| Ⅰ | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
| Ⅱ | 碱石灰 | 氯化钙 | 硅胶 | 氯化钠 |
| Ⅲ | 湿润的红纸条 | 干燥的红纸条 | 干燥的白纸条 | 干燥的红纸条 |
查看答案和解析>>
科目:高中化学 来源: 题型:
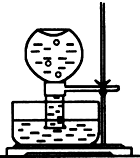 (1)如图所示,现有一瓶饱和氯水倒扣于水槽中,当日光照射到盛有氯水的装置时,可观察到平底烧瓶内有气泡产生,放置一段时间后溶液颜色变浅,产生上述现象的原因是(请用相关的反应方程式和简要文字说明)
(1)如图所示,现有一瓶饱和氯水倒扣于水槽中,当日光照射到盛有氯水的装置时,可观察到平底烧瓶内有气泡产生,放置一段时间后溶液颜色变浅,产生上述现象的原因是(请用相关的反应方程式和简要文字说明)查看答案和解析>>
科目:高中化学 来源: 题型:
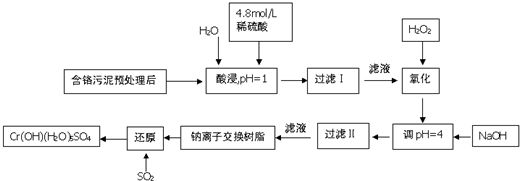
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | - |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0(>9.0溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该粉末中一定含有Al(NO3)3、KOH、NaCl |
| B、该粉末中一定含有Al(NO3)3、和KOH,但不能确定是否含有NaCl |
| C、该粉末中一定含有NaCl,但不能确定是否含有Al(NO3)3、和KOH |
| D、以上过程不能确定该溶液中含有哪种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com