
��14�֣���֪A(g)��B(g) C(g)��D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
C(g)��D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
�¶�/�� | 700 | 800 | 830 | 1000 | 1200 |
ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
��ش��������⣺
��1���÷�Ӧƽ�ⳣ������ʽΪK��______ ����H___0(ѡ�����������������)��
��2��830 ��ʱ����һ��5 L���ܱ������г���0.20 mol��A��0.80 mol��B������÷�Ӧ��ʼ��6 S��A��ƽ����Ӧ����v(A)��0.003 mol �� L-1�� S-1����6 Sʱc(A)��______ mol��L-1��C�����ʵ���Ϊ______ mol ��
��3�����루2����ͬ���¶ȡ�������A��B����·�Ӧ��һ��ʱ���ﵽƽ�⣬��ʱA��ת����Ϊ______�������ʱ����ܱ��������ٳ���1 mol�������ƽ��ʱA��ת����______ ��ѡ���������С���������䡱����
��4���жϸ÷�Ӧ�Ƿ�ﵽƽ�������Ϊ______(����ȷѡ�����ĸ)��
a��ѹǿ����ʱ��ı� b��������ܶȲ���ʱ��ı�
c��c(A)����ʱ��ı� d����λʱ��������C��D�����ʵ������
��5��1200 ��ʱ��ӦC(g)��D(g) A(g)��B(g)��ƽ�ⳣ����ֵΪ______ ��
A(g)��B(g)��ƽ�ⳣ����ֵΪ______ ��
��14�֣���ע��1���⣬����ÿ�ո�2�֣� ��1��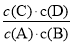 ����1�֣�
����1�֣�
��2�� 0.022 0.09 ��3�� 80% ���䣨1�֣� ��4�� c ��5�� 2.5
��������
�����������1����ѧƽ�ⳣ������һ�������£������淴Ӧ�ﵽƽ��״̬ʱ��������Ũ�ȵ���֮���ͷ�Ӧ��Ũ�ȵ���֮���ı�ֵ������ݷ���ʽ��֪�÷�Ӧ��ƽ�ⳣ������ʽK��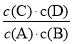 ���ɱ������ݿ�֪���¶�Խ��ƽ�ⳣ��ԽС��˵�������¶�ƽ�����淴Ӧ�ƶ���������Ӧ�Ƿ��ȷ�Ӧ������H��0��
���ɱ������ݿ�֪���¶�Խ��ƽ�ⳣ��ԽС��˵�������¶�ƽ�����淴Ӧ�ƶ���������Ӧ�Ƿ��ȷ�Ӧ������H��0��
��2����Ӧ��ʼ6s��A��ƽ����Ӧ����v��A����0.003mol?L-1?s-1����6s�ڡ�c��A����0.003mol?L-1?s-1��6s��0.018mol/L��A����ʼŨ��Ϊ0.2mol��5L��0.04mol/L����6sʱʱc��A����0.04mol/L-0.018mol/L��0.022mol/L����6s�ڡ�n��A����0.018mol/L��5L��0.09mol���ɷ���ʽ��֪n��C������n��A����0.09mol��
��3����ƽ��ʱA��Ũ�ȱ仯��Ϊx����
A��g��+B��g�� C��g��+D��g��
C��g��+D��g��
��ʼ��mol/L����0.04 0.16 0 0
�仯��mol/L����x x x x
ƽ�⣨mol/L����0.04-x 0.16-x x x
��x2/(0.04-x)(0.16-x)��1
���x��0.032
����ƽ��ʱA��ת����Ϊ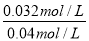 ��100%��80%
��100%��80%
������䣬����1mol�������Ӧ��������ֵ�Ũ�Ȳ��䣬�仯���ƶ���A��ת���ʲ��䣬Ϊ80%��
��4��a���÷�Ӧǰ����������ʵ������䣬ѹǿʼ�ղ��䣬��ѹǿ����ʱ��ı䣬����˵������ƽ�⣬��a���� b�������������������䣬�������ݻ����䣬�ʻ��������ܶ�ʼ�ղ��䣬��������ܶȲ���ʱ��ı䣬����˵������ƽ�⣬��b����c�����淴Ӧ����ƽ��ʱ������ֵ�Ũ�Ȳ������仯����c��A������ʱ��ı䣬˵������ƽ�⣬��c��ȷ��d����λʱ��������C��D�����ʵ�����ȣ�����ʾ����Ӧ���ʣ���Ӧʼ�հ�1��1����C��D�����ʵ���������˵������ƽ�⣬��d���ʴ�Ϊ��c��
��4��ͬһ��Ӧ����ͬ�¶��£������淴Ӧ�����ƽ�ⳣ����Ϊ��������1200��ʱ��ӦC��g��+D��g�� A��g��+B��g����ƽ�ⳣ����ֵΪ1��0.4��2.5��
A��g��+B��g����ƽ�ⳣ����ֵΪ1��0.4��2.5��
���㣺���黯ѧƽ����㡢ƽ�ⳣ�����㡢��ѧ��Ӧ���ʡ�ƽ��״̬�ж�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�����ʡ��У������ѧ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
51.2��ͭ��ȫ��������Ũ�����У��ռ��������������NO��NO2��N2O4���Ļ���ﹲ0.8 mol����Щ����ǡ���ܱ�500ml 2 mol��L-1 ������������Һ��ȫ���գ����ɵ���Ϊ�����ƺ��������ƣ����������е�NO�����ʵ���Ϊ �� ��
A�� 0.2 mol B��0.3 mol C��0.4 mol D��0.5 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�캣��ʡ�������Ĵ��¿���ѧ�Ծ��������棩 ���ͣ������
A��B��C��D��E��F���ֶ�����Ԫ�أ�ԭ��������������A�ǵؿ��к�����ߵ�Ԫ�أ�C�ǵؿ��к�����ߵĽ���Ԫ�أ�A��Eͬ���塣DԪ��ԭ�������������Ǵ�����������һ�롣B��C��Ԫ��ԭ�ӵ�����������֮�͵���DԪ��ԭ�ӵ�������������C��D��Ԫ��ԭ������������֮�͵���FԪ��ԭ�ӵ�������������
�ش��������⣺
��1��Ԫ��A��Ԫ�����ڱ��е�λ���� ��
��2��д��B��E��Ԫ���γɻ�����ĵ���ʽ�� ��������ѧ������ ��
��3��A��D��E��F����̬�⻯����ȶ���˳�� ���û�ѧʽ��ʾ��
��4��д��C��E��Ӧ������������ˮ�������Ӧ�Ļ�ѧ����ʽ�ǣ�
��5��C��D����������ֱ���B���������ﷴӦ�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�캣��ʡ�������Ĵ��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪ij��Һ��c(Na��)��0.2 mol/L��c(Mg2��)��0.25 mol/L��c(Cl��)��0.4 mol/L�������Һ�л���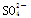 ����ôc(SO42-)ӦΪ
����ôc(SO42-)ӦΪ
A��0.1 mol/L B��0.3 mol/L C��0.15 mol/L D��0.5 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�캣��ʡ�������Ĵ��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӵ���������ֵ��NA��ʾ������˵����ȷ����
A����״���£�1.12L��������ԭ����Ϊ0.1NA
B��1.6gNH2�� ��������������ΪNA
C��22.4 LHCl����ˮ����Һ��H����ΪNA
D��9g D2O������������Ϊ4.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡЭ���������һ����Ӧ�Բ��������ۺϻ�ѧ���������棩 ���ͣ�ѡ����
���������������Ե�10-�ǻ�ϲ����Ľṹ��ͼ��ʾ��

���й���10���ǻ�ϲ�����˵����ȷ���ǣ� ��
A������ʽΪC20H16N2O5
B������FeCl3��Һ����������Ƿ���ˮ��
C�������ʿ���9mol H2�����ӳɷ�Ӧ
D��һ�������£�1mol�ֱ�����Na��NaOH��Na2CO3�ı�ֵΪ2�U2�U1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ������ѧ�ڻ�ͷ���Ի�ѧ�Ծ��������棩 ���ͣ������
��֪�����µ������£�pH��Ϊ5��H2SO4��Һ��NH4Cl��Һ���ش��������⣺
��1����ȡ5mL������Һ���ֱ��ˮϡ����50mL��pH�ϴ����________��Һ
��2����ȡ5mL������Һ���ֱ���ȣ��¶���ͬ����pH��С����________��Һ
��3��H2SO4��Һ��NH4Cl��Һ����ˮ�������c(H+)֮��Ϊ__________
��4��ȡ5mL NH4Cl��Һ����ˮϡ����50mL��c(H+) ____________ 10-6mol��L-1���>������<����=������
c(NH4+)��c(H+)_______________�����������С�����䡱��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ������ѧ�ڻ�ͷ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
X��Y��Z��M��WΪԭ���������������5�ֶ�����Ԫ�ء�X��������������Ӳ�����ͬ��Y��Z��Mͬ���������ڣ�Wԭ�Ӻ����������Mԭ��������������2����Z����ͬ����Ķ�����Ԫ�ؿ��γɳ�������ס�X��Y��Z 3��Ԫ���γɻ������ҡ�����˵������ȷ���� �� ��
A��ԭ�Ӱ뾶��W��Y��Z��M��X
B������������һ��ֻ�й��ۼ�
C����WԪ���γɵĵ����Լ�W��Z��Ԫ���γɵĻ����ﶼ��ԭ�Ӿ���
D��X�ֱ���Y��Z��M��W�γɵij����������У��ȶ�����õ���XM���е�X2Z��XM
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ������ʮУ�����������ѧ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
�ִ���ҵ�����Ȼ��ơ�������̼�Ͱ���Ϊԭ���Ʊ�������ֹ����������£�

�й�˵��������ǣ� ��
A����Ӧ��ԭ��ΪCO2 + NH3 + NaCl + H2O == NaHCO3�� + NH4Cl
B����NaCl��Һ����ͨ��������CO2����ͨ��������NH3
C����Ӧ�����ɵij������������ˡ�ϴ�ӡ����տɵõ�����
D����ĸҺ��ͨ�백��������ϸС��ʳ�ο��������£���ʹ�Ȼ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com