
茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )
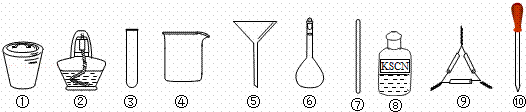
|
| A. | 将茶叶灼烧灰化,选用①、②和⑨ |
|
| B. | 用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ |
|
| C. | 过滤得到的滤液,选用④、⑤和⑦ |
|
| D. | 检验滤液中的Fe3+,选用③、⑧和⑩ |
| 真题集萃;过滤、分离与注入溶液的仪器;物质的检验和鉴别的实验方案设计. | |
| 专题: | 实验题. |
| 分析: | 检验茶叶中的铁元素,先将茶叶在坩埚中灼烧灰化,然后在烧杯中用浓硝酸溶解茶叶灰并加蒸馏水稀释,在漏斗中过滤,可取少量滤液于小试管中,用KSCN溶液检验,以此解答该题. |
| 解答: | 解:A.将茶叶灼烧灰化,应在坩埚中加热,用到的仪器有①、②和⑨,必要时还可用到三脚架或铁架台带铁圈,故A不选; B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,应在烧杯中进行,可用玻璃棒搅拌,不用容量瓶,故B选; C.过滤时用到④、⑤和⑦,故C不选; D.检验滤液中的Fe3+,可用胶头滴管取少量滤液于小试管中,用KSCN溶液检验,用到的仪器有试管、胶头滴管和滴瓶等,即③、⑧和⑩,故D不选. 故选B. |
| 点评: | 本题为2014年重庆高考题,侧重于物质的检验和鉴别的实验设计的考查,着重于考查学生的分析能力和实验能力,落脚于基础知识的考查,注意把握实验的原理、步骤和实验仪器,难度不大. |


科目:高中化学 来源: 题型:
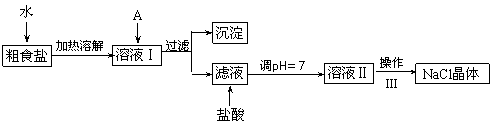
Ⅰ.食盐是日常生活的必需品,也是重要的化工原料。粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
 |
提供的试剂:
饱和Na2CO3溶液、 饱和K2CO3溶液 、NaOH溶液 、BaCl2溶液、Ba(NO3)2溶液
(1)欲除去溶液I中的Ca2+、Mg2+、SO42-离子,选出A所代表的试剂,按滴加顺序依次为 _______________________________________(只填化学式)。
(2)操作Ⅲ的名称是_________,所需用到的仪器主要有铁架台、酒精灯、铁圈、______________________ (填仪器名称)。
(3)加盐酸的目的是(用离子方程式表示) 、 。
Ⅱ.一份无色溶液中可能含有Na+ 、Fe3+、H+ 、Mg2+、CO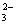 、OH-、HCO
、OH-、HCO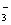 、Cl-、SO42-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
、Cl-、SO42-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
① 向溶液中滴加酚酞试液,溶液显红色;
② 取2 mL溶液,先加足量稀硝酸酸化,有气体产生,再加氯化钡溶液进行检验,没有明显现象;
(4)原溶液中一定存在的离子是 , 一定不存在的离子是 。
(5)经过上述操作后,还不能肯定是否存在的离子是 。对可能含有的离子,如何进行实验以进一步检验。 。
查看答案和解析>>
科目:高中化学 来源: 题型:
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:Ni(OH)2 + M NiOOH + MH 已知:6NiOOH + NH3 + H2O + OH-
NiOOH + MH 已知:6NiOOH + NH3 + H2O + OH- 6Ni(OH)2 + NO2-。下列说法正确的是( )
6Ni(OH)2 + NO2-。下列说法正确的是( )
A.NiMH 电池放电过程中,正极的电极反应式为:NiOOH + H2O + e- Ni(OH)2 + OH-
Ni(OH)2 + OH-
B.充电过程中OH-离子从阳极向阴极迁移
C.充电过程中阴极的电极反应式:H2O + M + e- MH + OH-,H2O中的H被M还原
MH + OH-,H2O中的H被M还原
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
已知钡的某种同位素是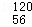 Ba,由学过的知识无法推断出的信息是( )
Ba,由学过的知识无法推断出的信息是( )
|
| A. | 钡原子的核外电子排布 | B. | 钡元素在周期表中的位置 |
|
| C. | 钡原子的核电荷数 | D. | 钡元素的相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是( )
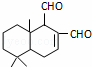
|
| A. | Br2的CCl4溶液 | B. | Ag(NH3)2OH溶液 | C. | HBr | D. | H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
双球连通管中发生2NO2⇌N2O4+Q(Q>0).若同时向两烧杯中分别加入等温、等体积的蒸馏水(左)和0.1mol/L H2O2溶液(右),再向右侧烧杯中加入少量Fe2(SO4)3固体后,则下列有关推断中正确的是( )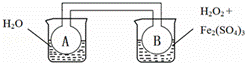
|
| A. | 实验时,A、B中的压强始终相等 |
|
| B. | 若右侧烧杯发生吸热反应,则A中更快达到平衡 |
|
| C. | 若右侧烧杯发生放热反应,则A中颜色较深 |
|
| D. | 能用该装置推断右侧烧杯中反应的热效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
不饱和酯类化合物在药物、涂料等领域应用广泛.下列反应是一种由烯烃制备不饱和酯的新方法:

(1)化合物I的分子式为 ,1mol化合物I能与 mol H2恰好完全反应生成饱和烃类化合物.
(2)化合物Ⅰ可由芳香族化合物Ⅱ或Ⅲ分别通过消去反应获得,但只有Ⅱ能与Na反应产生H2,Ⅱ的结构简式为 、 ;由Ⅲ生成Ⅰ的反应条件为 .
(3)聚合物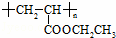 可用于制备涂料,其单体结构简式为 .若仅以乙烯为唯一有机物原料合成该聚合物,写出其中涉及的化学反应方程式
可用于制备涂料,其单体结构简式为 .若仅以乙烯为唯一有机物原料合成该聚合物,写出其中涉及的化学反应方程式
.
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等。下列说法正确的是( )
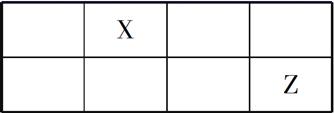
A.原子半径:r(Y)>r(Z)>r(W)
B.Y、Z、W的简单离子的电子层结构相同
C.XWm与YWn中化学键类型相同(m、n为正整数)
D.元素Z的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
某恒温密闭容器中,可逆反应A(s)  B+C(g)-Q达到平衡。缩小容器体积,重新达到
B+C(g)-Q达到平衡。缩小容器体积,重新达到
平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1
C.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com