
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源:2016届西藏日喀则地区一中高三10月月考理综化学试卷(解析版) 题型:填空题
【化学一有机化学基础】(15分)尼龙是目前世界上产量最大、应用范围最广、性能比较优异的一种合成纤维。以X为原料合成尼龙-66的流程如下:
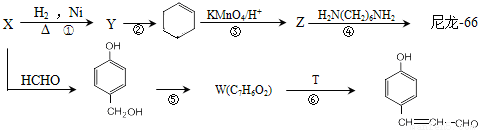
已知部分信息如下:
I.Z的化学式为C6H10O4。
Ⅱ.X和浓溴水反应产生白色沉淀。
Ⅲ.某些醛与醛之间能发生羟醛缩合反应,例如:
RCHO+CH3CHO RCH(OH)CH2CHO
RCH(OH)CH2CHO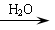 RCH=CHCHO+H2O
RCH=CHCHO+H2O
请回答下列问题:
(1)X的化学名称为_______。W的结构简式为_______。T的分子式为_________。
(2)反应②的条件为__________。
(3)写出反应④的化学方程式___________。反应⑤的类型为___________。
(4)G是Z少一个碳原子的同系物,M是G的同分异构体。M既能发生银镜反应和水解反应。又能和碳酸氢钠反应产生气体,M的结构共有种,其中,在核磁共振氢谱上有3个峰的结构简式为___。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东寿光中学高二上10月月考化学试卷(解析版) 题型:选择题
用石墨电极电解CuCl2溶液(如图)。下列分析正确的是
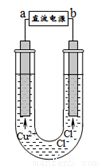
A.a端是直流电源的负极
B.通电使CuCl2发生电离
C.阳极上发生的反应:Cu2++2e-=Cu
D.通电一段时间后,在阴极附近观察到黄绿色气体
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期第三次月考化学试卷(解析版) 题型:实验题
某课外活动小组设计了以下实验验证Ag与浓硝酸反应的过程中可能产生NO,其实验流程图如下:

(1)测定硝酸的物质的量反应结束后,从如图装置B中所得100 mL溶液中取出25.00 mL溶液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为__________________________mol,则Ag与浓硝酸反应过程中生成的NO2在标准状况下的体积为_________________________mL。
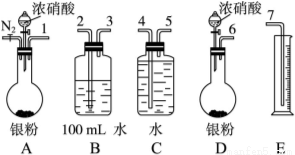
(2)测定NO的体积
①从如图所示的装置中,你认为应选用________装置进行Ag与浓硝酸反应实验,选用的理由是_______。
②选用如图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是______________(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置___________(填“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析
若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中____________(填“有”或“没有”)NO产生,作此判断的依据是_____________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一上期中测试化学试卷(解析版) 题型:选择题
在一定温度下,已知有关某饱和溶液的一些数据:①溶液的质量,②溶剂的质量,③溶液的体积,④溶质的摩尔质量,⑤溶质的溶解度,⑥溶液的密度,利用下列各组数据计算该饱和溶液的物质的量浓度,不能算出的一组是
A.④⑤⑥ B.①②③④ C.①④⑥ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
若不断地升高温度,实现“冰→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的粒子间的主要相互作用力依次是
A.氢键;分子间作用力;非极性共价键
B.氢键;氢键;极性共价键
C.氢键;极性共价键;分子间作用力
D.分子间作用力;氢键;非极性共价键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二上第一阶段测化学试卷(解析版) 题型:选择题
t ℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为K=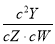 。有关该平衡体系的说法正确的是
。有关该平衡体系的说法正确的是
A.当混合气体的平均相对分子质量保持不变时,反应达平衡
B.增大压强,各物质的浓度不变
C.升高温度,平衡常数K增大
D.增加X的量,平衡既可能正向移动,也可能逆向移动
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
为了除去KCl固体中少量MgSO4和CaCl2杂质,须进行下列六项操作,正确的次序是①加水溶解; ②加热蒸发得到晶体; ③加入过量BaCl2溶液; ④加入过量盐酸; ⑤加入过量的K2CO3 ⑥过滤
A.①⑤③⑥④② B.①⑤③④⑥②
C.①③④⑥⑤② D.①③⑤⑥④②
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上10月阶段质检化学试卷(解析版) 题型:填空题
(16分)目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应。平衡常数(K1、K2、K3)如下所示:

请回答下列问题:
(1)反应②是______________(填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=_____________(用K1、K2表示)。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有_______________(填字母序号)
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.从平衡体系中及时分离出CH3OH
(4)500℃时,测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正____________v逆(填“>”、“=”或“<”).
(5)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它们在高温下能传导O2-离子,该电池的正极反应式为_________________。电池工作时,固体电解质里的O2-向_____________极移动。
(6)300℃时,在一定的压强下,5molCO与足量的H2在催化剂的作用下恰好完全反应变化的热量为454kJ。在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:

下列说法正确的是______________________。
A.2c1>c3 B.a+b<90.8 C.2p 2<p3 D.α1+α3<1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com