
| A. | 用物质A表示的平均反应速率为0.3mol/(L•s) | |
| B. | 用物质B表示的平均反应速率为0.6mol/(L•s) | |
| C. | 2s时物质A的转化率为70% | |
| D. | 2s时物质B的浓度为0.7mol•L-1 |
分析 v(C)=$\frac{0.6mol/L}{2s}$mol/(L.s)=0.3 mol•L-1•s-1,
A.同一可逆反应中同一时间内各物质的反应速率之比等于其计量数之比;
B.同一可逆反应中同一时间内各物质的反应速率之比等于其计量数之比;
C.2s时,生成n(C)=0.6mol/L×2L=1.2mol,则参加反应的n(A)=n(C)=1.2mol,A的转化率=$\frac{参加反应的物质的量}{初始物质的量}$×100%;
D.2s时,生成n(C)=0.6mol/L×2L=1.2mol,则参加反应的n(B)=$\frac{1}{2}$n(C)=$\frac{1}{2}$×1.2mol=0.6mol,剩余n(B)=(2-0.6)mol=1.4mol,根据c=$\frac{n}{V}$计算平衡时B的浓度.
解答 解:v(C)=$\frac{0.6mol/L}{2s}$mol/(L.s)=0.3 mol•L-1•s-1,
A.同一可逆反应中同一时间内各物质的反应速率之比等于其计量数之比,所以v(A)=v(C)=0.3 mol•L-1•s-1,故A正确;
B.同一可逆反应中同一时间内各物质的反应速率之比等于其计量数之比,所以v(B)=$\frac{1}{2}$v(C)=$\frac{1}{2}$×0.3 mol•L-1•s-1=0.15mol•L-1•s-1,故B错误;
C.2s时,生成n(C)=0.6mol/L×2L=1.2mol,则参加反应的n(A)=n(C)=1.2mol,A的转化率为:$\frac{1.2mol}{4mol}$×100%=30%,故C错误;
D.2s时,生成n(C)=0.6mol/L×2L=1.2mol,则参加反应的n(B)=$\frac{1}{2}$n(C)=$\frac{1}{2}$×1.2mol=0.6mol=0.6mol,剩余n(B)=(2-0.6)mol=1.4mol,则2s时B的浓度为:c(B)=$\frac{1.4mol}{2L}$=0.7mol/L,故D正确;
故选AD.
点评 本题考查化学平衡计算,题目难度中等,涉及反应速率、平衡浓度、转化率的计算,明确反应速率与计量数的关系是解本题关键,会根据公式进行推导,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:10:1010:109 | B. | 1:5:5×109:5×108 | C. | 5×108:5×109:5:1 | D. | 1010:109:10:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
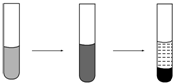 某溶液中可能存在Mg2+、Fe2+、Fe3+,加入NaOH溶液,开始时有白色絮状沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色,下列结论正确的是( )
某溶液中可能存在Mg2+、Fe2+、Fe3+,加入NaOH溶液,开始时有白色絮状沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色,下列结论正确的是( )| A. | 一定有Fe2+,一定没有Fe3+、Mg2+ | |
| B. | 一定有Fe3+,一定没有Fe2+、Mg2+ | |
| C. | 一定有Fe3+,可能有Fe2+,一定没有Mg2+ | |
| D. | 一定有Fe2+,可能有Mg2+,一定没有Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com