
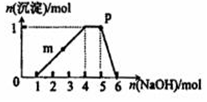
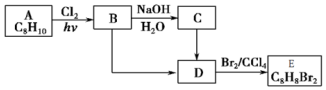
 某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-等离子.向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如右图所示.下列有关判断正确的是( )
某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-等离子.向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如右图所示.下列有关判断正确的是( )| A. | m点处反应:H++OH-═H2O | |
| B. | p点:c(NH4+)>c(OH-)>c(H+) | |
| C. | 若取原溶液做焰色反应实验,焰色应为黄色 | |
| D. | 原溶液中存在的主要离子:n(H+)=n(NH4+)=n(Al3+) |
分析 由图可知,开始加入1mol NaOH没有沉淀和气体产生,则一定有H+;然后加入氢氧化钠有沉淀产生且最后完全消失,则一定没有Fe3+,一定含有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3•H2O的反应,则含有NH4+,由电荷守恒可知一定含有SO42-,据此分析解答.
解答 解:由图可知,开始加入NaOH没有沉淀和气体产生,则一定有H+;后来有沉淀产生且最后完全消失,则一定没有Fe3+,一定含有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3•H2O的反应,则含有NH4+,由电荷守恒可知一定含有SO42-,
A.m点后沉淀的量逐渐增加,发生反应为Al3++3OH-=Al(OH)3↓,故A错误;
B.p点溶质为一水合氨按和硫酸钠,氢氧根离子来自水的电离和一水合氨按的电离,则c(NH4+)<c(OH-),故B错误;
C.根据分析可知,无法确定是否含有Na+,则取原溶液做焰色反应实验,焰色不一定为黄色,故C错误;
D.开始加入1mol NaOH时,溶液无沉淀产生,说明溶液中有H+,且其物质的量为1mol;产生沉淀和沉淀溶解所需的NaOH的物质的量为3:1,所以溶液中有Al3+且其物质的量为1mol;当加入4~5 mol NaOH时,发生的反应为NH4++OH-═NH3•H2O,所以溶液中NH4+为1mol,则原溶液中n(H+)=n(NH4+)=n(Al3+),故D正确;
故选D.
点评 本题考查了离子反应、离子的鉴别,题目难度中等,熟悉相关离子的性质、明确图象中各段的含义及发生的反应是解题关键,注意铝离子的性质,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
| 选项 | 反应或用途 | 性质或结论 |
| A | 常温下,碳能与浓硝酸剧烈反应 | 浓硝酸具有强氧化性 |
| B | SiO2既能与氢氟酸反应,又能与氢氧化钠溶液反应 | SiO2是两性氧化物 |
| C | 氯水能使红色石蕊试纸变白 | 氯水具有漂白性 |
| D | 向含有酚酞的FeCl3溶液中滴入KSCN溶液,溶液变红色 | KSCN溶液呈碱性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
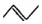
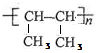 .
.
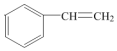 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
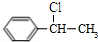 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$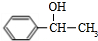 +NaCl;
+NaCl;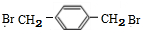 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者分别与少量邻羟基苯甲酸作用,所得产物相同 | |
| B. | 若将二者均配成0.1mol/L的溶液,前者的pH较大 | |
| C. | 分别加入过量盐酸充分反应后,二者产生CO2的体积在标准状况下均为2.24L | |
| D. | 若将二者分别加入1mL水中充分搅拌,恢复至室温后,只有后者有固体剩余 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8×l0-7mol/L | B. | 1.0×l0-5mol/L | C. | 1.0×l0-7mol/L | D. | 1.8×l0-9mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 证明某红棕色气体是溴蒸气还是NO2,可用湿润的淀粉一KI试纸检验,观察试纸颜色的变化 | |
| B. | SO2通入足量的Fe(NO3)3稀溶液中,溶液由棕黄色变为浅绿色,但立即又变成棕黄色,假设通入的SO2完全反应,则同温同压下,逸出气体和SO2的体积比为2:3 | |
| C. | 验证淀粉水解产物是否具有还原性,取水解液于试管中加入新制氢氧化铜悬浊液,加热煮沸,观察是否出现砖红色沉淀 | |
| D. | 在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去,该过程中总反应为2A1+3Ag2S═6Ag+Al2S3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
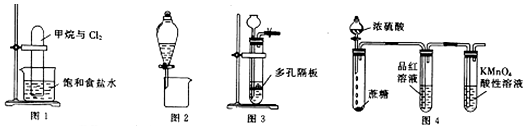
| A. | 图1可实现甲烷与氯气在光照条件下的置换反应 | |
| B. | 图2可分离CH3CH3OH和CH3COOC2H5的混合液 | |
| C. | 图3可用于锌粒与稀硝酸反应制备氢气 | |
| D. | 图4可说明浓H2SO4具有脱水性和强氧化性,SO2具有漂白性和还原性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com