
| A. | 22.4LNH3分子中含有3NA个N-H键 | |
| B. | 2.3 g Na完全与O2反应生成3.6 g产物时失去的电子数为0.1NA | |
| C. | 1 L0.1 mol•L-1蔗糖溶液中所含分子数为0.1NA | |
| D. | 常温常压下,46g NO2含有的原子数小于3NA |
分析 A.气体状况未知;
B.求出钠的物质的量,然后根据反应后钠元素为+1价来分析;
C.蔗糖溶液中含有蔗糖、水分子;
D.依据n=$\frac{m}{M}$计算物质的量,结合分子式计算原子数,原子守恒.
解答 解:A.气体状况未知,Vm不确定,不能使用气体摩尔体积计算氨气的物质的量,故A错误;
B.2.3g钠的物质的量为0.1mol,而反应后钠元素为+1价,故0.1mol钠失去0.1mol电子即0.1NA个,故B正确;
C.蔗糖溶液中含有蔗糖、水分子,所以1 L0.1 mol•L-1蔗糖溶液中所含分子数远远大于0.1NA,故C错误;
D.依据n=$\frac{m}{M}$计算物质的量=$\frac{46g}{46g/mol}$=1mol,原子守恒46g NO2含有的原子数等于3NA,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的分析应用,掌握物质的量的计算公式和物质结构是解题关键,注意气体摩尔体积使用条件和对象,题目难度不大.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | 随核电荷数的增加 X-的半径递增,还原性递减(用X表示卤素原子) | |
| B. | 氢化物的稳定性随核电荷数的增加逐渐增强 | |
| C. | 单质与水反应均可表示为 X2+H2O═HX+HXO(用X表示卤素原子) | |
| D. | 单质的颜色随核电荷数的增加逐渐加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 目的 | 操作 | |
| A | 提纯含有少量乙酸的乙酸乙酯 | 向含有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,振荡后静置分液,并除去有机相的水 |
| B | 检验溴乙烷中的溴元素 | 取样,加NaOH溶液,振荡后再加AgNO3溶液 |
| C | 提纯含有少量苯酚的苯 | 向含有少量苯酚的苯中加入过量的浓溴水振荡后静置过滤,除去三溴苯酚沉淀 |
| D | 检验蔗糖是否水解 | 蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察现象 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
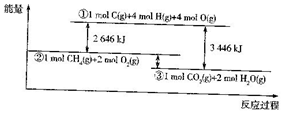 如图表示甲烷和氧气反应过程中的能量变化:请回答下列问题:
如图表示甲烷和氧气反应过程中的能量变化:请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
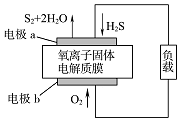 新华网报道:我国固体氧化物燃料电池技术研发取得新突破.科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示.下列说法正确的是( )
新华网报道:我国固体氧化物燃料电池技术研发取得新突破.科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示.下列说法正确的是( )| A. | 电极b为电池的负极 | |
| B. | 电路中每流过4 mol电子,正极消耗44.8 L H2S | |
| C. | 电极b上的电极反应为:O2+4e-+4H+═2H2O | |
| D. | 电极a上的电极反应为:2H2S+2O2--4e-═S2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 球棍模型: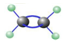 | B. | 分子中六个原子在同一平面上 | ||
| C. | 键角:109o28’ | D. | 碳碳双键中的一根键容易断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ①中物质 | ②中的物质 | 预测②中的现象和结论 |  |
| A | 浓盐酸 | 二氧化锰 | 立即产生大量黄绿色气体,证明 HC1具有还原性和酸性 | |
| B | 草酸溶液 | 酸性高锰酸钾溶液 | 溶液逐渐褪色,证明草酸具有还原性 | |
| C | 硫酸铝饱和溶液 | 碳酸钠饱和溶液 | 立即产生大量气泡,证明两者相互促进水解 | |
| D | 蒸馏水 | 过氧化钠粉末 | 立即产生大量气泡,滴加酚酞溶液后变红,说明过氧化钠是碱性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.请回答下列问题:
碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LHF中的原子数目为2NA | |
| B. | 在18 g18O2中含有NA个氧原子 | |
| C. | 常温常压下,17g的NH3含有的电子数为10NA | |
| D. | NA 个CO2分子中含有4mol极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com