
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | … | 23 | 24 |
| C2H6 | C2H6O | C2H4O2 | C3H8 | C3H8O | C3H6O2 | C4H10 | … | M | N |
| A. | M为C9H20O | B. | N为C9H18O2 | ||
| C. | M、N均可发生加成反应 | D. | M、N均可能发生取代反应 |
分析 根据表中排布可知,每3个为一组,第一组碳原子为数为2,分别符合通式CnH2n+2、CnH2n+2O、CnH2nO2,第二组碳原子为数为3,分别符合通式CnH2n+2、CnH2n+2O、CnH2nO2,所以按此规律排布的第23项是第8组中的第2个,分子式为C9H20O,第24项为第8组的第三个,其分子式为C9H18O2,据此再结合有机物结构与性质进行判断.
解答 解:根据表中排布可知,每3个为一组,第一组碳原子为数为2,分别符合通式CnH2n+2、CnH2n+2O、CnH2nO2,第二组碳原子为数为3,分别符合通式CnH2n+2、CnH2n+2O、CnH2nO2,所以按此规律排布的第23项是第8组中的第2个,分子式为C9H20O,第24项为第8组的第三个,其分子式为C9H18O2,
A.根据分析可知,M的分子式为C9H20O,故A正确;
B.根据分析可知,N的分子式为C9H18O2,故B正确;
C.M为C9H20O,根据氢离子数目可知其分子已经达到饱和结构,不存在不饱和键,故不能发生加成反应,故C错误;
D.M为C9H20O,可能为醇类物质,N为C9H18O2,可能为羧酸,醇和羧酸都能够发生酯化反应,酯化反应属于取代反应,故D正确;
故选C.
点评 本题主要考查探究化学规律,题目难度中等,根据表中排布规律推导出MN的分子式为解题的关键,试题侧重考查学生的分析、归纳能力及灵活应用基础知识的能力,注意掌握常见有机物结构与性质.


科目:高中化学 来源: 题型:解答题
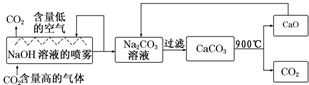
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
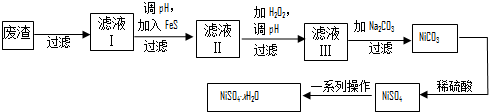
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
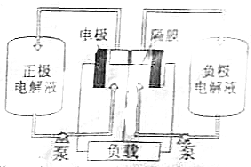 偏钒酸铵(NH4VO3)为白色或微黄色的晶体粉末,微溶于水和氨水,而难溶于冷水,在钒的湿法冶金中占重要地位.
偏钒酸铵(NH4VO3)为白色或微黄色的晶体粉末,微溶于水和氨水,而难溶于冷水,在钒的湿法冶金中占重要地位.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 微粒 | A | B | C | D |
| 原子核数 | 双核 | 多核 | 多核 | 多核 |
| 所带单位电荷 | -1 | 0 | +1 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作设计 | 现象记录 | 结论解释 | |
| A | 将少量浓硝酸逐滴加入Cu 和稀硫酸的混合物中 | 产生红棕色气体 | 硝酸被还原为NO2 |
| B | 用坩埚钳夹住铝箔在酒精灯 上加热 | 铝箔熔化但并不滴落 | 熔点:Al2 O3>Al |
| C | 向某氯化亚铁溶液中加入 Na2O2粉末 | 出现红褐色沉淀 | 加入Na2O2粉末前,原氯化 亚铁溶液已经变质 |
| D | 向紫色石蕊试液中持续长时 间通人氯气 | 溶液先变红,最后变 为无色 | 氯气有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H、C、O、Na | B. | H、K、O、S | C. | H、O、S | D. | H、N、O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
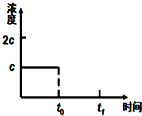 请你利用所学反应原理知识解决下列问题:
请你利用所学反应原理知识解决下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将足量Cl2通入溴化亚铁溶液:2Fe2++Cl2=2Fe3++2Cl- | |
| B. | 氯气通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| C. | AlCl3溶液中通入过量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| D. | 碳酸氢钠和稀硫酸反应:CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com