
 ;AB2的结构式是O=C=O.
;AB2的结构式是O=C=O.分析 A、B、C、D、E均是短周期元素,其原子序数依次增大,A原子最外层电子数是内层电子数的二倍,则A为碳元素,A和D同族,则D为硅元素,A和B同周期,B元素族序数是周期数的三倍,则B为氧元素,B的阴离子与C的阳离子电子层结构相同,C的单质与 B 的单质在不同条件下反应,可生成C2B或C2B2,则C为钠元素,E是所在周期中原子半径最小的元素,则E为氯元素,以此解答该题.
解答 解:A、B、C、D、E均是短周期元素,其原子序数依次增大,A原子最外层电子数是内层电子数的二倍,则A为碳元素,A和D同族,则D为硅元素,A和B同周期,B元素族序数是周期数的三倍,则B为氧元素,B的阴离子与C的阳离子电子层结构相同,C的单质与 B 的单质在不同条件下反应,可生成C2B或C2B2,则C为钠元素,E是所在周期中原子半径最小的元素,则E为氯元素,
(1)D为硅元素,在元素周期表中第三周期第ⅣA族,
故答案为:第三周期第ⅣA族;
(2)C2B为氧化钠,它的电子式是 ;AB2为二氧化碳,它的结构式是 O=C=O,
;AB2为二氧化碳,它的结构式是 O=C=O,
故答案为: ;O=C=O;
;O=C=O;
(3)电子层数越多,离子半径越大,电子层数相同时,核电荷数越多,离子半径越小,所以B、C、E离子半径的由大到小的顺序为Cl->O2->Na+,元素的非金属性越强,对应的最高价氧化物对应水化物的酸性就越强,非金属性Cl>C>Si,所以酸性由强到弱的顺序为HClO4>H2CO3>H2SiO3,
故答案为:Cl->O2->Na+;HClO4>H2CO3>H2SiO3;
(4)由于水分子之间有氢键且是极性分子,所以水的沸点高于H2S,
故答案为:H2O;水分子之间有氢键;
(5)用ClO2可氧化Mn2+,生成黑色沉淀MnO2,当消耗13.50g (即0.2mol)ClO2时,共转移了1mol电子,根据电子得失守恒可写出反应的离子方程式为2ClO2+5Mn2++6H2O=5MnO2↓+2Cl-+12H+,
故答案为:2ClO2+5Mn2++6H2O=5MnO2↓+2Cl-+12H+.
点评 本题考查结构性质位置关系应用,为高考常见题型,侧重于学生的分析能力的考查,推断元素是解题关键,侧重对基础知识的巩固,注意对基础知识的掌握,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 用25 mL量筒量取12.36 mL盐酸 | |
| B. | 用pH试纸测出某溶液pH为3.5 | |
| C. | 用托盘天平称取8.75 g食盐 | |
| D. | 用酸式滴定管测出消耗盐酸的体积为15.60 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:实验题
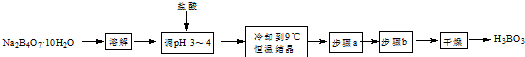
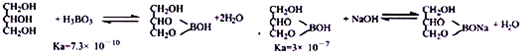
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
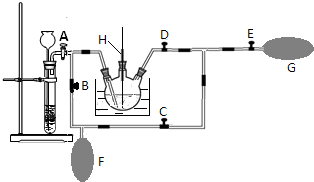
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2$\stackrel{HCl(aq)}{→}$SiCl4$→_{还原}^{H_{2}}$Si | |
| B. | N2$→_{高温、高压、催化剂}^{H_{2}}$NH3$\stackrel{HCl(aq)}{→}$NH4Cl(aq) | |
| C. | FeS2$→_{还原}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| D. | MgCO3$\stackrel{HCl(aq)}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
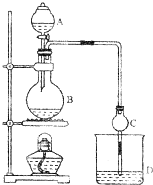 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、乙酸,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、乙酸,D中放有饱和碳酸钠溶液.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应,A是常见的金属单质,D是无色气体单质、F是黄绿色气态单质,反应①②均在水溶液中进行的.
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应,A是常见的金属单质,D是无色气体单质、F是黄绿色气态单质,反应①②均在水溶液中进行的.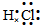 ,
,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com