
【题目】下列与化学反应能量变化相关的叙述正确的是
A. 生成物总能量一定低于反应物总能量
B. 拆开物质中的化学键一定需要吸收能量
C. 应用盖斯定律,无法计算某些难以直接测量的反应焓变
D. 化学反应都伴随着能量变化和其他各种现象的出现
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在25.00ml碱式滴定管中盛有溶液,液面恰好在20.00ml刻度处,现将滴定管中全部溶液放出,流入量筒内,所得溶液体积为( )
A. 5mL B. 20mL C. 大于5mL D. 小于5mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0.
2SO3(g) ΔH<0.
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是( )

A. 图Ⅰ表示的是t1时刻增大压强对反应速率的影响
B. 图Ⅱ表示的是t1时刻加入催化剂对反应速率的影响
C. 图Ⅲ 表示的是温度对平衡的影响,且T甲小于T乙
D. 图Ⅲ表示的是催化剂对化学平衡的影响,乙使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如下:(所加试剂均过量,气体全部逸出)
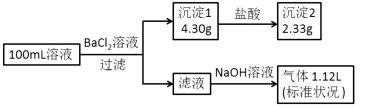
下列说法不正确的是( )
A.原溶液一定存在CO32-和SO42-,一定不存在Fe3+
B.原溶液一定存在Cl-,可能存在Na+
C.原溶液中c(Cl-)≥0.1mol·L-1
D.若原溶液中不存在Na+,则c(Cl-)<0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一铁的氧化物样品,用50mL5mol/L的盐酸恰好完全溶解,所得溶液还能与通入的0.56L氯气(标准状况)反应,使Fe2+全部转化为Fe3+,则此氧化物为
A. Fe2O3 B. Fe3O4 C. Fe4O5 D. Fe5O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列十种物质:①蔗糖②熔融NaCl③石墨④铜丝⑤NaOH固体⑥SO2⑦NaHSO4固体⑧K2O固体⑨液态H2SO4⑩饱和FeCl3溶液 上述物质中可导电的是________(填序号,下同);上述物质中不能导电,但属于电解质的是_______________________。
(2)NaHSO4是一种酸式盐,请填写下列空白:
①NaHSO4晶体熔化时的电离方程式为______________________________。
②3 mol·L-1 NaHSO4与2 mol·L-1 Ba(OH)2溶液等体积混合,该反应总的离子方程为___________。
(3)实验室制备少量Fe(OH)3胶体所用的物质有__________(填序号),反应的离子方程式为________________________________________________。
(4)某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO4-、H2O、Mn2+、H2O2、H+,已知该反应中H2O2只发生了如下过程:H2O2→O2。写出该反应的离子方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NH4HCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。(已知:NH4HCO3=NH3↑+CO2↑+H2O)

(1)操作②为什么不用硝酸钡溶液,其理由是_______________________________;
(2)进行操作②后,如何判断SO42-已除尽,方法是___________________________;
(3)操作③的目的是____________,其中涉及到的离子方程式是_______________;
(4)往滤液中加入盐酸的离子方程式是__________________________________;
(5)NH4HCO3在水溶液中的电离方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为__________、_______。
(2)用甲烷制取氢气的两步反应的能量变化如下图所示:

甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是________________。
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5KJ/mol
②NH2CO2NH4(s)= CO(NH2)2(s) +H2O(g) △H=+116.5KJ/mol
③H2O(l)=H2O(g) △H=+44KJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式__________________。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com