
| 1000ρω |
| M |
| 1000×1.84×98% |
| 98 |


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
| A、18g NH4+ 所含原子数为4NA |
| B、10g氖气所含原子数约为6.02×1023 |
| C、标准状况下,22.4L H2O所含的分子数为NA |
| D、常温常压下,32g O2和O3的混合气体所含原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
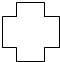 某环烷烃的结构像红十字会的会徽,因此有人称它为“红十字烷”结构如图,其分子式为
某环烷烃的结构像红十字会的会徽,因此有人称它为“红十字烷”结构如图,其分子式为查看答案和解析>>
科目:高中化学 来源: 题型:
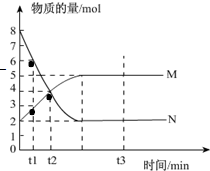 I、一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
I、一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:| a |
| b |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
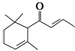 分子式为C13H20O,有关该化合物的下列说法正确的是( )
分子式为C13H20O,有关该化合物的下列说法正确的是( )| A、一定条件下1mol该化合物最多可与2mol氢气加成 |
| B、该化合物可发生银镜反应 |
| C、1mol该化合物完全燃烧消耗19mol O2 |
| D、该化合物可发生加聚反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com