

分析 (1)根据盖斯定律来计算化学反应的焓变;
(2)①160℃、CuO/CeO2作催化剂时,CO优先氧化为二氧化碳;
②灼烧草酸铈[Ce2(C2O4)3],分解制得CeO2、一氧化碳以及二氧化碳,配平方程式即可;
③CuO/CeO2催化剂催化性能最好,即化学反应速率最快,据图象来回答;催化剂为CuO/CeO2-HIO3,120℃时,CO的转化率是80%来计算回答;
(3)在燃料点池中,氢离子移向正极,在负极上发生燃料失电子的氧化反应.
解答 解:(1)已知:①C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1=-110.35kJ•mol-1
②2H2O(l)═2H2(g)+O2(g)△H2=+571.6kJ•mol-1
③H2O(l)═H2O(g)△H3=+44.0kJ•mol-1
则:反应C(s)+H2O(g)═CO(g)+H2(g)可以是①+②×$\frac{1}{2}$-③得到,所以△H4=①+②×$\frac{1}{2}$-③=(-110.35kJ•mol-1)+(571.6kJ•mol-1)×$\frac{1}{2}$-44.0kJ•mol-1
=+131.45kJ/mol,故答案为:+131.45kJ/mol;
(2)①160℃、CuO/CeO2作催化剂时,CO优先氧化为二氧化碳,方程式为:2CO+O2$\frac{\underline{\;CuO/CeO_{2}\;}}{160℃}$2CO2,故答案为:2CO+O2$\frac{\underline{\;CuO/CeO_{2}\;}}{160℃}$2CO2;
②灼烧草酸铈[Ce2(C2O4)3],分解制得CeO2、一氧化碳以及二氧化碳,即 Ce2(C2O4)3$\frac{\underline{\;高温\;}}{\;}$2CeO2+4CO↑+2CO2↑,故答案为:Ce2(C2O4)3$\frac{\underline{\;高温\;}}{\;}$2CeO2+4CO↑+2CO2↑;
③CuO/CeO2催化剂催化性能最好,即化学反应速率最快,据图象知道当HIO3加入时,催化性能最好,催化剂为CuO/CeO2-,120℃时,CO的转化率是80%,气体混合物流速为1800mL•h-1;体积分数为:0.98%的CO,则反应1小时后CO的体积为$\frac{1}{4}$×1800×1×0.98%×80%=3.528,故答案为:HIO3;3.528;
(3)在燃料点池中,氢离子移向正极b极,所以a是负极,在负极上发生燃料失电子的氧化反应:HCOOH-2e-=CO2+2H+,故答案为:a;HCOOH-2e-=CO2+2H+.
点评 本题目综合考查学生电化学、热化学、盖斯定律的应用等综合知识,注意知识的归纳和整理是关键,难度中等.


 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将CO2转化为 CH4,既可以减少温室气体的排放,又能得到清洁能源.已知:
将CO2转化为 CH4,既可以减少温室气体的排放,又能得到清洁能源.已知:| A. | 0~25h内,催化剂Ⅰ的催化效果比催化剂Ⅱ的效果好 | |
| B. | 0~16h内,v(H2O)Ⅰ=1.5 mol/(L•h) | |
| C. | 在两种不同催化剂下,该反应的平衡常数不相等 | |
| D. | 反应开始后的15h内,第Ⅰ种催化剂的作用下,得到的CH4最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内总压强不再变化 | B. | 混合气体的密度不再变化 | ||
| C. | 混合气体的平均摩尔质量不再变化 | D. | 混合气体的总质量不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学在实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置进行测定中和热的实验,得到表中的数据:
某同学在实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置进行测定中和热的实验,得到表中的数据:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验编号 | 1 | 2 | 3 |
| 混合物的质量/g | 3.76 | 4.70 | 8.46 |
| 硫酸溶液的体积/mL | 50.00 | 50.00 | 50.00 |
| 生成二氧化碳的物质的量/mol | 0.03 | 0.0375 | 0.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
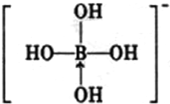 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com