
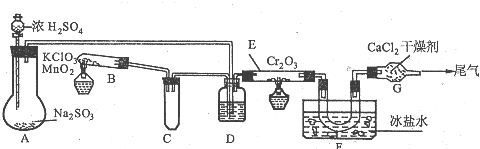
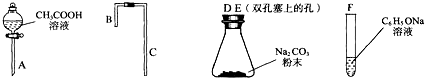
分析 (1)制取气体的装置需要检查装置的气密性;
(2)B装置中氯酸钾加热分解生成氯化钾和氧气,据此写出反应的方程式;
(3)C中的导管能够起到缓冲、防倒吸的作用;
(4)A、B装置中生成的气体需要在E中加热反应,所以气体必须为干燥的,据此判断D中试剂;利用装置和反应速率、反应的转化来分析;
(5)正反应为放热反应,温度过高不利于三氧化硫的生成;
(6)根据二氧化硫的物理性质分析装置F中U型关内收集到的物质的颜色、状态.
解答 解:(1)凡是有到导气的实验装置,都需要进行气密性检验(特别是有毒气体通过的装置),这一步骤在安装好整个装置之后,装入药品之前进行.所以,实验前,必须进行的操作是检查装置的气密性,
故答案为:检查装置的气密性;
(2)B中氯酸钾在二氧化锰作催化剂条件下加热分解生成氯化钾和氧气,反应的化学方程式为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,
故答案为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
(3)实验过程用到加热操作以及气体易溶于水的要防倒吸,实验中B装置通过加热制备O2并将其通入溶液,要防止因反应容器内压强锐减而造成液体倒吸入热的反应容器内.所以小试管C的作用是缓冲、防止D中的液体倒吸到B中,
故答案为:缓冲、防止倒吸;
(4)生成的二氧化硫需要在装置E中加热反应,所以气体进入装置E前需要干燥,故D中为浓硫酸;
气体SO2和O2 在E试管中以Cr2O3作催化剂、加热条件制备SO3,并且SO3易吸水.为实验安全、防止催化剂中毒以便得到SO3固体,进入E试管的气体应干燥.气体SO2和O2在催化剂表面反应生成SO3,为充分反应、原料利用充分,防止浪费.进入E试管的气体要充分混合,气流不能过快;所以,装置D的作用是①干燥SO2和O2 ②使SO2和O2混合均匀 ③通过观察控制气体比例和气流速度,
故答案为:浓硫酸;干燥SO2和O2;使SO2和O2混合均匀;通过观察控制气体比例和气流速度;
(5)当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防温度过高,因生成三氧化硫的反应正反应为放热反应,温度过高不利于三氧化硫的生成,且影响催化剂的活性,
故答案为:该反应放热,温度过高不利于SO3的生成,且影响催化剂的活性;
(6)E中二氧化硫与氧气催化氧化生成三氧化硫,三氧化硫的熔点较低,则在F的冰盐水中形成无色晶体或白固固体,
故答案为:无色晶体或白固固体.
点评 本题考查了制备方案的设计,题目难度中等,明确实验目的、实验原理为解答关键,注意二氧化硫、氧气及三氧化硫的制备原理,试题培养了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠常用于远途运输鱼苗的供氧 | |
| B. | 侯式制碱法的工艺过程中应用了物质的溶解性差异 | |
| C. | 加工后具有吸水性的植物纤维可用作食品干燥剂 | |
| D. | 使用含有钙离子浓度较大的地下水洗衣服,肥皂的去污能力减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
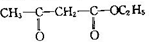 )和聚乙烯醇(PVA)都是重要的有机化工产品,其合成路线如图所示.
)和聚乙烯醇(PVA)都是重要的有机化工产品,其合成路线如图所示.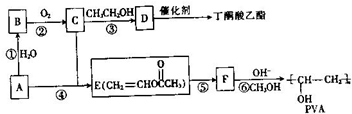
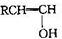 不稳定会自动转化为RCH2CHO.
不稳定会自动转化为RCH2CHO.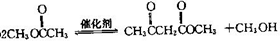
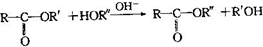
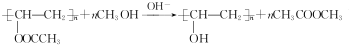 ,该反应的反应类型为取代反应.
,该反应的反应类型为取代反应.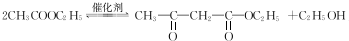 ,Na与生成的乙醇反应,平衡右移,提高D的转化率.(根据化学方程式和平衡移动原理回答)
,Na与生成的乙醇反应,平衡右移,提高D的转化率.(根据化学方程式和平衡移动原理回答) 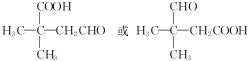 (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 编号 | 实验操作 | 实验现象 | 结论及解释 |
| 1 | 分别取4种溶液,滴加紫色石蕊溶液 | 溶液变红的是①④溶液 | 略 |
| 2 | 向含酚酞的NaOH溶液中,各滴加等量的②③两种溶液 | ②中无明显现象 ③中红色明显变浅 | 滴加③时反应的化学方程式: C6H5OH+NaOH→C6H5ONa+H2O |
| 3 | 配制等物质的量浓度的CH3COONa、NaHCO3溶液,并比较其pH | NaHCO3溶液pH大于CH3COONa溶液 | 略 |
| 4 | 将CO2通入C6H5ONa溶液中 | 产生白色浑浊 | 反应的化学方程式:C6H5ONa+CO2+H2O=C6H5OH+NaHCO3 |
| 结论:4种物质的羟基中的氢原子的活泼性由强到弱的顺序是(填序号)④①③② | |||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g乙烯和环丁烷的混合气体中含有的碳原子数为2NA | |
| B. | 常温常压下,46gNO2和N2O4的混合气体中含有的原子数为3NA | |
| C. | 标准状况下,22.4L水中含有的质子数为10NA | |
| D. | 1molNa与足量的O2反应,生成Na2O和Na2O2的混合物,转移电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
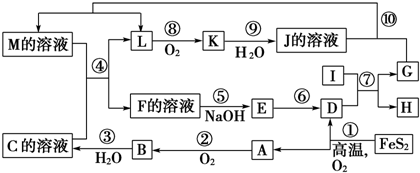
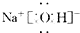
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
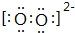 .
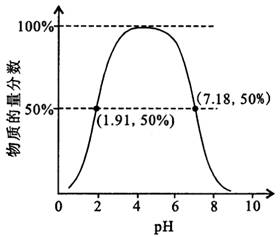
. 
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com