
【题目】某研究性学习小组欲开展一次以化学为主题的活动,确定的课题是“研究浓硫酸与木炭粉在加热条件下反应的产物”。根据小组成员的推测,浓硫酸与木炭粉在加热条件下反应的产物可能有CO2、SO2,为了验证推测,小组讨论用以下装置进行实验:
编号 | a | b | c |
装置 |
品红 酸性KMnO4 品红 溶液 溶液 溶液 A B C |
|
|
请回答:
⑴ 实验时可观察装置a中A瓶溶液褪色,C瓶溶液不褪色。则A瓶溶液的作用___,C瓶溶液的作用_____;
⑵ 装置b中所加的液体是________,装置b可验证的产物是________;
⑶ 甲、乙两位同学分别设计了两套不同装置。甲的装置顺序:c→b→a,乙的装置顺序:c→a→b。你认为合理的是(填“甲”或“乙”)__;
⑷写出装置c中发生的化学方程式: __________
【答案】检验是否存在SO2 检验SO2 是否除尽 澄清石灰水或Ca(OH)2溶液 CO2 乙 C+2H2SO4(浓)![]() CO2+2SO2+2H2O
CO2+2SO2+2H2O
【解析】
本实验的目的是验证木炭和浓硫酸的反应产物有CO2、SO2;检验CO2一般用澄清石灰水,但SO2也可以使澄清石灰水变浑浊,所以要先验证是否含有二氧化硫,然后将二氧化硫除去,再验证是否含有CO2,二者都为酸性氧化物,所以验证和除去二氧化硫时要利用二氧化硫和二氧化碳的不同之处,例如二氧化硫的漂白性和还原性,所以具体的实验装置可以是:利用c进行木炭和浓硫酸的反应,之后连接a,装置A检验二氧化硫,装置B吸收二氧化硫,装置C检验二氧化硫是否吸收完全,之后再连接b,b中盛放澄清石灰水来检验二氧化碳。
(1)根据分析可知A瓶作用是检验是否存在SO2;C瓶作用是检验SO2是否除尽;
(2)装置b用来检验CO2,可以用澄清石灰水;
(3)根据分析可知乙同学的连接顺序合理;
(4)c中为木炭和浓硫酸加热条件下的反应,方程式为C+2H2SO4(浓)![]() CO2+2SO2+2H2O。
CO2+2SO2+2H2O。


科目:高中化学 来源: 题型:
【题目】下列分子中,各分子的立体构型和中心原子的杂化方式均正确的是( )
A. NH3 平面三角形 sp3杂化 B. CCl4 正四面体 sp3杂化
C. H2O V形 sp2杂化 D. CO32﹣ 三角锥形 sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述及解释正确的是
A. 2NO2(g)(红棕色)![]() N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B. 对于C(s) + O2(g) ![]() 2CO(g) ,在平衡后,加入碳,平衡向正反应方向移动
2CO(g) ,在平衡后,加入碳,平衡向正反应方向移动
C. FeCl3+3KSCN![]() Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
D. 对于N2+3H2![]() 2NH3,平衡后,压强不变,充入O2,平衡向逆方向移动
2NH3,平衡后,压强不变,充入O2,平衡向逆方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语或描述中,不正确的有
①F-的结构示意图:![]()
②氢氧根的电子式:![]()
③HClO的结构式:H—Cl—O
④SO3的水溶液能导电,说明SO3是电解质
⑤NaHSO3在水中的电离方程式:NaHSO3=Na++H++SO32-
⑥同素异形体间的转化和同位素间的转化都是化学变化
A. 1项 B. 2项 C. 5项 D. 6项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图1所示:


(1)根据表数据,请你判断该电池工作的适宜应控制
在_____(填字母)范围内。
A.100℃以下 B.100~300℃
C.300~350℃ D.350~2050℃
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050 |
沸点/℃ | 892 | 444.6 | 2980 |
(2)放电时,电极A为_____极,电极B发生_____反应(填“氧化或还原”)。
(3)充电时,总反应为Na2Sx=2Na+xS,则阳极的电极反应式为:________________。
(4)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如图2所示,槽内的中间用阴离子交换膜隔开。通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。则右侧发生的电极方程式:________________;试分析左侧溶液蓝色逐渐变浅的可能原因是:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴酸锂废极片中钴回收的某种工艺流程如下图所示,其中废极片的主要成分为钴酸锂(LiCoO2)和金属铝,最终可得到Co2O3及锂盐。
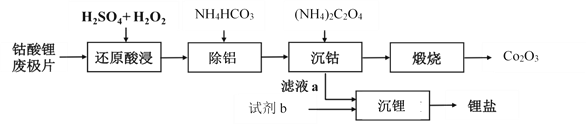
(1) “还原酸浸”过程中,大部分LiCoO2可转化为CoSO4,请将该反应的化学方程式补充完整:2LiCoO2+3H2SO4+□ ![]() □CoSO4+□ +□ + □ 。__________
□CoSO4+□ +□ + □ 。__________
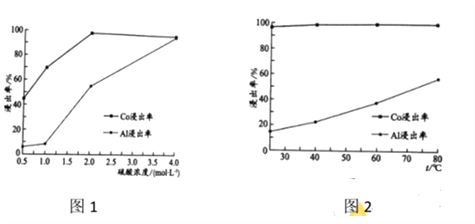
(2) “还原酸浸”过程中,Co、Al浸出率(进入溶液中的某元素质量占固体中该元素总质量的百分数)受硫酸浓度及温度(t)的影响分别如图1和图2所示。工艺流程中所选择的硫酸浓度为2 mol.L-1,温度为80 oC,推测其原因是________。
A. Co的浸出率较高 B. Co和Al浸出的速率较快
C. Al的浸出率较高 D. 双氧水较易分解
(3)加入(NH4)2C2O4后得CoC2O4沉淀。写出CoC2O4沉淀在空气中高温煅烧得到Co2O3的反应的化学方程式:________。
(4)若初始投入钴酸锂废极片的质量为1 kg,煅烧后获得Co2O3的质量为83 g,已知Co的浸出率为90%,则钴酸锂废极片中钴元素的质量分数约为________(小数点后保留两位)。
(5)已知“沉锂”过程中,滤液a中的c(Li+)约为10-1 mol·L-1,部分锂盐的溶解度数据如下表所示。
温度 | Li2SO4 | Li2CO3 |
0 oC | 36.1 g | 1.33 g |
100 oC | 24.0 g | 0.72 g |
结合数据分析,沉锂过程所用的试剂b是________(写化学式),相应的操作方法:向滤液a中加入略过量的试剂b,搅拌,________,洗涤干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于2甲基1丁烯[CH2=C(CH3)CH2CH3]的说法错误的是( )
A. 与1-丁烯(CH2=CHCH2CH3)互为同系物
B. 官能团有甲基、碳碳双键
C. 该有机物的所有碳原子可能共平面
D. 与环戊烷(![]() )互为同分异构体
)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.100 mol·L-1的NaOH溶液滴定20.00 mL 0.100 mol·L-1的HNO2溶液,![]() 与所加NaOH溶液体积的关系如图所示,下列说法错误的是( )
与所加NaOH溶液体积的关系如图所示,下列说法错误的是( )

A. 25 ℃时,0.100 mol·L-1的HNO2溶液的pH=2.75
B. B点对应的溶液中,2c(H+)+c(HNO2)=c(NO2-)+2c(OH-)
C. C点对应的溶液的pH=7,加入NaOH溶液的体积为20.00 mL
D. 滴定过程中从A到D点溶液中水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程。

下列有关说法正确的是
A.制取NaHCO3的反应是先往精盐溶液中通入CO2,再通入NH3
B.氯碱工业在阳极产生使湿润淀粉碘化钾试纸变蓝的气体
C.可直接加热MgCl2·6H2O制备无水MgCl2
D.在步骤④中,SO2水溶液吸收Br2后,溶液的pH值增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com