
| A.12 | B.7 | C.6 | D.2 |
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源:不详 题型:填空题
 H++SO42—。
H++SO42—。| A.c(Na+)=c(SO42—)+c(HSO4—)+c(H2SO4) |
| B.c(OH—)=c(HSO4—)+c(H+) |
| C.c(Na+)+c(H+)=c(OH—)+c(HSO4—)+2c(SO42—) |
| D.c(Na+)="2" c(SO42—)+2 c(HSO4—) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 质未标出)。回答下列问题:
质未标出)。回答下列问题: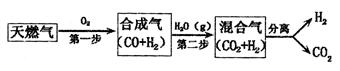
 CH3OH(g)某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见下图:
CH3OH(g)某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见下图: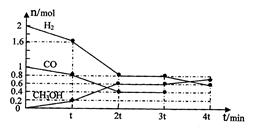
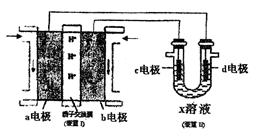
 极(填“a”或“b”)移动;b电极上发生的反应为 。
极(填“a”或“b”)移动;b电极上发生的反应为 。 达式为 (用m和V1的代数式表示)。
达式为 (用m和V1的代数式表示)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
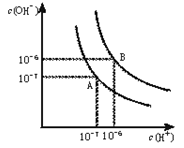
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
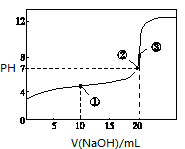
| A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) |
| B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) |
| C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
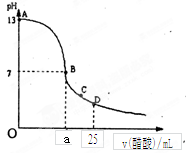
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 .30mol/LCH3COOH水溶液 ⑤50毫升0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是__________ _。
.30mol/LCH3COOH水溶液 ⑤50毫升0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是__________ _。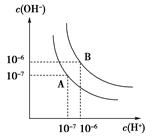

| A.c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| C.c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] |
| D.c(CO32-)=c(HCO3-)+c(H2CO3) |
 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com