
【题目】某新型二次电池反应原理为M+3Cn(MCl4)+4MC14-![]() 4M2C17-+3Cn(M代表金属,Cn代表石墨)。装置如图所示。下列说法正确的是
4M2C17-+3Cn(M代表金属,Cn代表石墨)。装置如图所示。下列说法正确的是
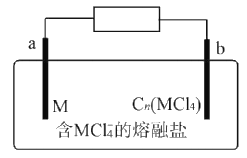
A. 放电时,MCl4-向b极迁移
B. 放电时,a极反应为M-3e-+7MCl4-=4M2Cl7-
C. 充电时,阳极反应式为Cn+MCl4-+e-=Cn(MCl4)
D. 电路上每转移lmol电子最多有3 mol Cn(MCl4)被还原
【答案】B
【解析】
由二次电池反应原理可知,放电时,a极为电池的负极,负极上M失电子发生氧化反应生成M2Cl7-,电极反应式为M-3e-+7MCl4-=4M2Cl7-,b极为正极,Cn(MCl4)在正极上得电子发生还原反应生成Cn,电极反应式为Cn(MCl4)+e-= Cn+MCl4-,充电时,a极为阴极、b极为阳极。
A项、放电时,阴离子向负极移动,a极为电池的负极,则MCl4-向a极迁移,故A错误;
B项、放电时,a极为电池的负极,负极上M失电子发生氧化反应生成M2Cl7-,电极反应式为M-3e-+7MCl4-=4M2Cl7-,故B正确;
C项、充电时,b极为阳极,Cn在阳极上失电子发生氧化反应生成Cn(MCl4),电极反应式为Cn+MCl4-—e-=Cn(MCl4),故C错误;
D项、由二次电池反应方程式可知,每转移3mol电子有3 mol Cn(MCl4)被还原,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。
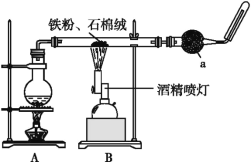
(1)已知该实验反应的反应方程式为:Fe+H2O![]() Fe3O4+H2(请配平)____。
Fe3O4+H2(请配平)____。
(2)仪器a的名称是________。
(3)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。
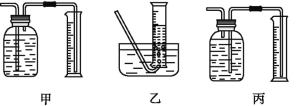
①该同学应该先点燃___(填“A”或“B”)处的酒精灯(或酒精喷灯),测量气体体积不可以选用上图中___(填“甲”“乙”或“丙”)装置。
②称取5.6 g铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为0.448 L,则铁粉的转化率为___。
(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,为探究反应后溶液中可能的阳离子,小林同学进行如下实验,请你将下表补充完整:
步骤 | 现象 | 解释(用离子方程式表示) | 结论 |
Ⅰ.取样,滴加KSCN溶液 | 溶液不变红色 | ①Fe3O4+8H+=Fe2++2Fe3++4H2O ②____________ | Ⅲ.反应后的溶液中阳离子为_______ |
Ⅱ.取样,滴加NaOH溶液 | 刚开始无明显现象,一段时间后先出现白色沉淀,迅速变为灰绿色,最终变为红褐色 | ①____________ ②Fe2++2OH—=Fe(OH)2↓ ③4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y两根金属棒插入Z溶液中构成如图的装置,实验中电流表指针发生偏转,同时X棒变粗,Y棒变细,则X、Y、Z可能是( )
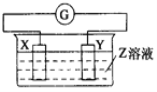
选项 | X | Y | Z |
A | Zn | Cu | 稀硫酸 |
B | Cu | Zn | 稀硫酸 |
C | Cu | Ag | 硫酸铜溶液 |
D | Ag | Zn | 硝酸银溶液 |
A.AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科学需要借助化学专用语言来描述,下列化学用语表达正确的是
A.乙醇的结构简式:C2H6OB.氯离子的结构示意图:![]()
C.羟基的电子式:![]() D.CH4分子的球棍模型:
D.CH4分子的球棍模型:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于图像的描述错误的是( )
A.图I表示向盐酸中滴加NaAlO2溶液,沉淀质量随NaAlO2溶液体积的变化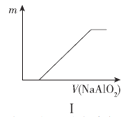
B.图II表示向NH4Al(SO4)2溶液中滴加NaOH溶液,沉淀质量随NaOH溶液体积的变化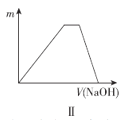
C.图III表示向NH4Cl溶液中加入稍过量Na2O2固体,产生气体的体积随Na2O2质量的变化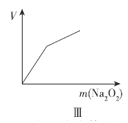
D.图IV表示向Na2CO3溶液中滴加稀盐酸,产生气体的体积随盐酸溶液体积的变化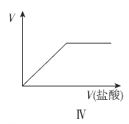
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】400℃时,将一定量的SO2和14molO2压入一个盛有催化剂的10L密闭容器中进行反应:2SO2+O22SO3。已知2min时,容器中剩余2molSO2和12molO2。试计算:
(1)SO2的起始物质的量浓度__________________。
(2)2min内SO3的反应速率____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容密闭容器中进行反应2X(g)+Y(g)![]() 2Z(g),测得某时刻X、Y、Z的浓度分别为0.2mol·L-1、0.1mol·L-1、0.2mol·L-1,则反应经一段时间后,下列测定数据一定不正确的是( )
2Z(g),测得某时刻X、Y、Z的浓度分别为0.2mol·L-1、0.1mol·L-1、0.2mol·L-1,则反应经一段时间后,下列测定数据一定不正确的是( )
A.c(X)=0.25mol·L-1
B.c(Y)=0.15mol·L-1
C.c(X)+c(Y)=0.4mol·L-1
D.c(Z)=0.4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取出少量黑色固体,洗涤后,__(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3Fe(CN)6溶液,产生蓝色沉淀,说明溶液中含有__。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是__(用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3min时量少;溶液红色较3min时加深 |
ⅲ | 120 | 产生白色沉淀;较30min时量少;溶液红色较30min时变浅 |
(资料:Ag+与SCN-生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于__(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据__现象,判断溶液中存在Ag+,可产生Fe3+。
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的__溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色。
实验Ⅱ:装置如图。其中甲溶液是__,操作及现象是__。
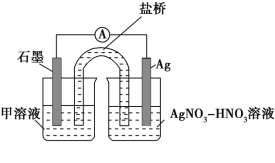
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式书写错误的是
A.乙醇催化氧化制取乙醛:2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
B.乙烯使溴的四氯化碳溶液褪色:CH2=CH2+Br2→CH2Br—CH2Br
C.CH4和Cl2混合后光照:CH4+Cl2![]() CH2Cl2+H2
CH2Cl2+H2
D.乙酸和乙醇发生反应生成乙酸乙酯:CH3CH2OH+CH3COOH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com