

分析 (1)与汽油相比,氢气作为燃料的优点有污染小、可再生、来源广、资源丰富、燃烧热值高等;碱性氢氧燃料电池的负极反应式为H2+2OH--2e-=2H2O;
(2)根据图示信息,反应物的能量低于产物的能量,所以反应是吸热反应,反应热等于产物的能量和反应物的能量之差;
(3)MHx(s)+yH2(g)?MHx+2y(s)△H<0,该反应属于气体的物质的量发生变化的反应,a.平衡时气体的物质的量不变,容器内气体压强保持不变;b.该反应为可逆反应,不能完全转化,吸收ymol H2需大于1mol MHx;c.若降温,平衡正向移动,该反应的平衡常数增大;d.若向容器内通入少量氢气,相当于增大压强,平衡正向移动,则v(放氢)<v(吸氢);
(4)①根据题意镍电极有气泡产生是氢离子放电生成氢气,铁电极发生氧化反应,溶液中的氢氧根离子减少;
②氢气具有还原性,根据题意Na2FeO4只在强碱性条件下稳定,易被H2还原.电解过程中,须将阴极产生的气体及时排出,防止Na2FeO4与H2反应使产率降低;
③根据题意Na2FeO4只在强碱性条件下稳定,在M点,c(OH-)低,Na2FeO4稳定性差,且反应慢,在N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低;
(5)A、B反应温度相等,则平衡常数相等,利用平衡常数计算.
解答 解:(1)与汽油相比,氢气作为燃料的优点有污染小、可再生、来源广、资源丰富、燃烧热值高等;碱性氢氧燃料电池的负极反应式为H2+2OH--2e-=2H2O,
故答案为:污染小、可再生、来源广、资源丰富、燃烧热值高;H2+2OH--2e-=2H2O;
(2)根据图示信息,反应物的能量低于产物的能量,所以反应是吸热反应,反应热等于产物的能量和反应物的能量之差,即CH4(g)+H2O(g)?CO(g)+3H2(g)△H=3(E2-E1),
故答案为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=3(E2-E1);
(3)MHx(s)+yH2(g)?MHx+2y(s)△H<0,该反应属于气体的物质的量发生变化的反应,a.平衡时气体的物质的量不变,容器内气体压强保持不变,正确;b.该反应为可逆反应,不能完全转化,吸收ymol H2需大于1mol MHx,错误;c.若降温,平衡正向移动,该反应的平衡常数增大,正确;d.若向容器内通入少量氢气,相当于增大压强,平衡正向移动,则v(放氢)<v(吸氢),错误;
故选ac;
(4)①根据题意镍电极有气泡产生是氢离子放电生成氢气,铁电极发生氧化反应,溶液中的氢氧根离子减少,因此电解一段时间后,c(OH-)降低的区域在阳极室,
故答案为:阳极室;
②氢气具有还原性,根据题意Na2FeO4只在强碱性条件下稳定,易被H2还原.电解过程中,须将阴极产生的气体及时排出,防止Na2FeO4与H2反应使产率降低,
故答案为:防止Na2FeO4与H2反应使产率降低;
③根据题意Na2FeO4只在强碱性条件下稳定,在M点,c(OH-)低,Na2FeO4稳定性差,且反应慢,在N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低,
故答案为:N点:c(OH)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低;
(5)分析图象可知,A状态下CO的转化率为0.5,则CO转化了10mol×0.5=5mol,
CO(g)+2H2(g)?CH3OH
起始物质的量:10 20 0
转化物质的量:5 10 5
平衡物质的量:5 10 5
当达到平衡状态A时,容器的体积为20L.则平衡常数K=$\frac{5}{5×1{0}^{2}}$=0.01,
A、B两容器温度相同,即化学平衡常数相等,且B点时CO的转化率为0.8,
则 CO(g)+2H2(g)?CH3OH(g)
起始(mol):10 20 0
转化(mol):8 16 8
平衡(mol):2 4 8
设体积为VL,则有K=$\frac{\frac{8}{V}}{\frac{2}{V}×(\frac{4}{V})^{2}}$=0.01,
V=0.2,
故答案为:0.2L.
点评 本题综合考查化学平衡计算、电解原理、影响化学平衡的因素等知识点,侧重考查学生分析、计算能力,正确分析图象及灵活运用化学反应原理是解本题关键,难点是电解池中电极反应式的书写.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
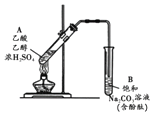 某同学利用如图所示装置制备乙酸乙酯.实验如下:
某同学利用如图所示装置制备乙酸乙酯.实验如下:| A. | ①中加热利于加快酯化反应速率,故温度越高越好 | |
| B. | ③中油状液体层变薄主要是乙酸乙酯溶于Na2CO3溶液所致 | |
| C. | ③中红色褪去的原因可能是酚酞溶于乙酸乙酯中 | |
| D. | 取②中上层油状液体测其核磁共振氢谱,共有3组峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=4.0 ×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+)-2c(OH- )=c(CH3COO-)-c(CH3COOH) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+ )>c(OH? )=c(H+) | |
| D. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl- )+c(ClO- )+c(OH? ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U互为同位素 | |
| B. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu互为同素异形体 | |
| C. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu具有相同的最外层电子数 | |
| D. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U具有完全相同的化学性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗,这利用了胶体的渗析原理 | |
| B. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装中放入生石灰或硅胶 | |
| C. | 小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| D. | 化工厂可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com