

分析 无隔膜电解槽中持续电解饱和氯化钠溶液,则电解生成的氯气和氢氧化钠反应生成氯酸钠溶液,通二氧化硫和X酸还原氯酸钠溶液生成二氧化氯,再用双氧水、氢氧化钠吸收反应生成亚氯酸钠,过滤的亚氯酸钠(NaClO2)溶液通过蒸发结晶得到亚氯酸钠晶体,
(1)根据电解池中阳极失去电子结合产物书写;
(2)由于ClO2气体在中性和碱性溶液中不能稳定存在,所以只能在酸性环境中存在,由于在酸性条件下,氯酸钠容易和盐酸发生氧化还原反应,所以X应该是硫酸.
(3)H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能过高,其目的是防止H2O2分解.
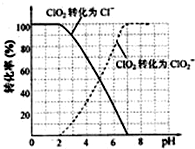
(4)根据图象可知,pH≤2时ClO2被还原为Cl-,所以该反应的离子方程式是2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O.
(5)由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释,以防止爆炸;
(6)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体.
解答 解:无隔膜电解槽中持续电解饱和氯化钠溶液,则电解生成的氯气和氢氧化钠反应生成氯酸钠溶液,通二氧化硫和X酸还原氯酸钠溶液生成二氧化氯,再用双氧水、氢氧化钠吸收反应生成亚氯酸钠,过滤的亚氯酸钠(NaClO2)溶液通过蒸发结晶得到亚氯酸钠晶体,
(1)电解池中阳极失去电子,所以溶液中的氯离子在阳极失去电子,因此反应的电极反应式是Cl--6e-+6OH-=ClO3-+3H2O,
故答案为:Cl--6e-+6OH-=ClO3-+3H2O;
(2)由于ClO2气体在中性和碱性溶液中不能稳定存在,所以只能在酸性环境中存在.由于在酸性条件下,氯酸钠容易和盐酸发生氧化还原反应,所以X应该是硫酸,故答案为:ClO2只能在酸性环境中存在; 硫酸;
(3)H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能过高,其目的是防止H2O2分解,
故答案为:防止H2O2分解;
(4)根据图象可知,pH≤2时ClO2被还原为Cl-,所以该反应的离子方程式是2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O,
故答案为:2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O;
(5)由信息②可知,纯ClO2易分解爆炸,发生器中鼓入空气的作用应是稀释ClO2,以防止爆炸,
故答案为:稀释ClO2气体,防止爆炸;
(6)从溶液中得到含结晶水的晶体,只能采取蒸发浓缩、冷却结晶、过滤得到粗晶体,
故答案为:蒸发浓缩;冷却结晶;过滤.
点评 本题以过氧化氢法制备亚氯酸钠为主线,考查学生阅读题目获取信息的能力、对浓度概念的理解、对氧化还原反应相关知识的运用、有关实验操作和简单实验设计能力考察以及在新情境下综合运用知识解决问题的能力,题目有一定的难度.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5个 | B. | 4个 | C. | 3个 | D. | 2个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知可逆反应A(g)+B(g)?C(g)+D(g)过程中的能量(kJ)变化如图所示,回答下列问题:
已知可逆反应A(g)+B(g)?C(g)+D(g)过程中的能量(kJ)变化如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是实验室制取乙酸乙酯的装置.请回答下列问题:
如图是实验室制取乙酸乙酯的装置.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水和碘化钾反应:Cl2+2I-=2Cl-+I2 | |
| B. | 二氧化锰和盐酸制氯气:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑ | |
| C. | 氯气制漂白粉:2OH-+Cl2=Cl-+Cl0-+H2O | |
| D. | 氯气和水反应:Cl2+H2O=H++Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外小组的同学拟用废铝箔制取硫酸铝晶体,已知铝的物种类别与溶液pH关系如图所示.
某课外小组的同学拟用废铝箔制取硫酸铝晶体,已知铝的物种类别与溶液pH关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,在该反应中,当有3NA电子转移时,上述热化学反应方程式的焓变为△H=-46.2KJ/mol | |
| B. | 1L 0.1mol•L-1碳酸钠溶液的阴离子总数等于0.1NA | |
| C. | 室温下pH=13的NaOH溶液中含有的OH-0.1NA | |
| D. | 浓度分别为1mol•L-1和0.5mol•L-1的CH3COOH和CH3COONa混合液共1L,含CH3COOH和CH3COO-共1.5mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com