
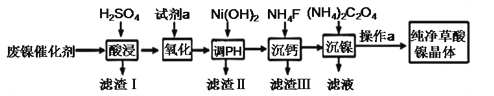
【题目】草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上用废镍催化剂(成分主要为Ni ,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(NiC2O4)= 4.05×1010
(1)“酸浸”前将废镍催化剂粉碎的目的是:____。“滤渣Ⅰ”的主要成分为:____。
(2)若试剂a为H2O2 ,写出氧化时反应的离子方程式:____。
(3)调节pH的范围为:____。
(4)写出“沉钙”操作中加入NH4F时发生反应的离子方程式:____,NH4F的电子式为:____。
(5)如果“沉镍”操作后测得滤液中C2O42 的浓度为0.18 mol·L1,则溶液中c(Ni2+)= ____ mol·L1。
(6)将得到的草酸镍晶体在真空中加热至320℃分解,可重新制得单质镍催化剂。该制备过程的化学方程式为:____。
【答案】 增大接触面积,提高酸浸速率 SiO2 2Fe2++2H++H2O2=2Fe3++2H2O 5.0≤pH<6.8 (写为5.0~6.8亦可) Ca2++2F-=CaF2↓ 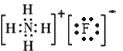 2.25×10-9 NiC2O4·2H2O=Ni+2CO2↑+2H2O
2.25×10-9 NiC2O4·2H2O=Ni+2CO2↑+2H2O
【解析】试题分析:(1)将废镍催化剂粉碎可以增大与酸的接触面积;Al2O3、Fe、SiO2、CaO中SiO2不与硫酸反应;(2)H2O2把Fe2+氧化为Fe3+;(3)根据流程图,调节pH的目的是除去Fe3+、Al3+;(4)加入NH4F的目的是生成氟化钙沉淀;NH4F是离子化合物;(5)根据Ksp(NiC2O4)= 4.05×1010计算c(Ni2+);(6)草酸镍晶体加热至320℃生成单质镍、二氧化碳、水;
解析:(1)将废镍催化剂粉碎可以增大与酸的接触面积,提高酸浸速率;Al2O3、Fe、SiO2、CaO中SiO2不与硫酸反应,所以“滤渣Ⅰ”的主要成分为SiO2;(2)H2O2把Fe2+氧化为Fe3+,反应的离子方程式是2Fe2++2H++H2O2=2Fe3++2H2O;(3)完全除去Fe3+、Al3+的最小PH是5.0,保证Ni2+不生成沉淀的PH小于6.8,所以PH 的范围是5.0≤pH<6.8;(4)加入NH4F的目的是生成氟化钙沉淀,反应的离子方程式是Ca2++2F-=CaF2↓;NH4F是离子化合物,电子式是 ;(5)根据Ksp(NiC2O4)= 4.05×1010,c(Ni2+)=
;(5)根据Ksp(NiC2O4)= 4.05×1010,c(Ni2+)=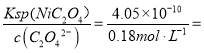 2.25×10-9;(6)草酸镍晶体加热至320℃生成单质镍、二氧化碳、水,反应方程式是NiC2O4·2H2O=Ni+2CO2↑+2H2O。
2.25×10-9;(6)草酸镍晶体加热至320℃生成单质镍、二氧化碳、水,反应方程式是NiC2O4·2H2O=Ni+2CO2↑+2H2O。


科目:高中化学 来源: 题型:
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是
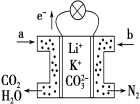
A.a为O2,b为CH4
B.CO 32-向正极移动
C.此电池在常温时也能工作
D.正极电极反应式为2CO2+O2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图回答,下列说法不正确的是( )
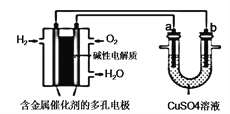
A. 此装置用于电镀铜时,电解一段时间,理论上硫酸铜溶液的浓度不变
B. 若a为粗铜,b为纯铜,该装置可用于粗铜的电解精炼
C. 燃料电池中负极反应为2H2-4e-+4OH- = 4H2O
D. 上述装置在工作过程中Cu2+ 向a电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中发生的化学反应是取代反应的是
A. 苯和溴水混合后,静置分层 B. 苯在空气中燃烧
C. 葡萄糖在酒化酶作用下生成酒精和CO2 D. 淀粉在稀硫酸作用下水解生成葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极),下列说法正确的是( )

A. 电池工作时,正极反应式为O2+2H2O+4e-===4OH-
B. 电解时,电子流动路径是负极→外电路→阴极→溶液→阳极→正极
C. 试管中NaOH溶液用来吸收电解时产生的Cl2
D. 当电池中消耗2.24 L(标准状况下)H2时,b极周围会产生0.021 mol气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com